Wyszukaj w publikacjach
Opryszczkowate zapalenie skóry – wskazówki diagnostyczno-terapeutyczne
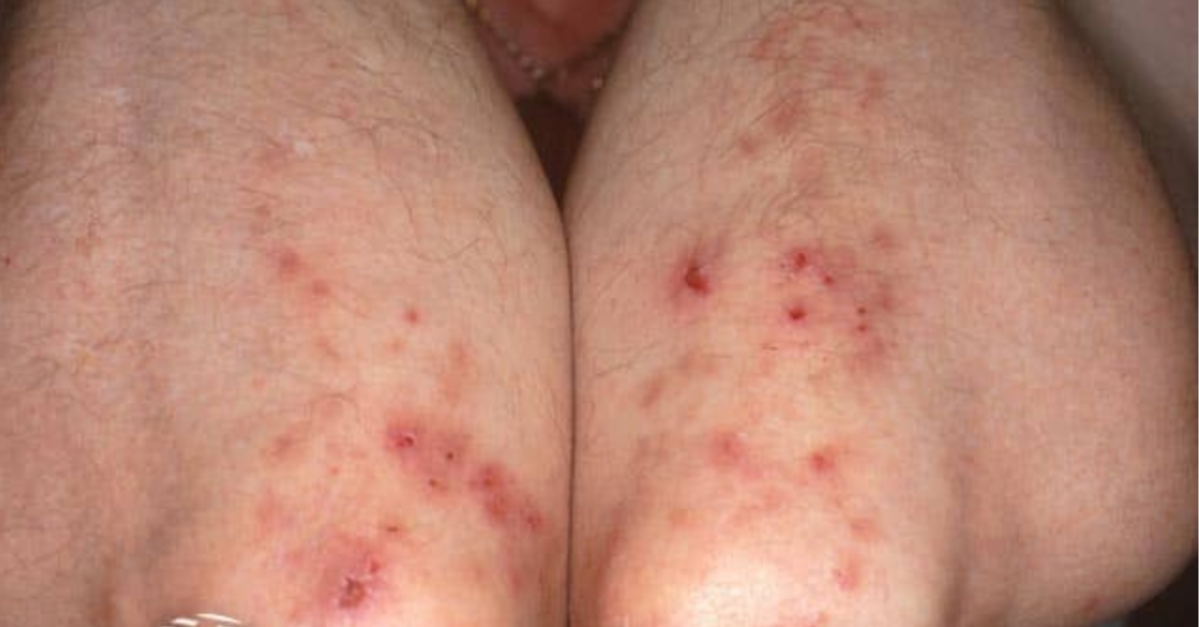
Opryszczkowate zapalenie skóry, znane także jako choroba Duhringa, to rzadkie i przewlekłe schorzenie autoimmunizacyjne. Jest spowodowane nadwrażliwością na gluten i stanowi skórną manifestację choroby trzewnej (celiakii). Nieleczona może mieć charakter wieloukładowy, co przejawia się występowaniem objawów pozaskórnych. Ze względu na swój często mylący obraz kliniczny stanowi wyzwanie diagnostyczne.
Jak dochodzi do rozwoju choroby Duhringa? Etiopatogeneza
Opryszczkowate zapalenie skóry ma złożoną patogenezę opartą na interakcji czynników:
- genetycznych – haplotypy HLA-DQ2 oraz HLA-DQ8 odgrywają kluczową rolę w procesie rozpoznawania antygenu glutenowego (gliadyny);
- środowiskowych – gliadyna, obecna w pszenicy, życie, jęczmieniu, orkiszu, kamucie i pszenżycie, stanowi główny czynnik wyzwalający rozwój choroby;
- immunologicznych – produkcja autoprzeciwciał przeciwko transglutaminazie 2 (transglutaminazie tkankowej, TG2/tTG) w tkance jelitowej oraz transglutaminazie 3 (transglutaminazie naskórkowej, TG3/eTG) w skórze.
Patogeneza świądu pozostaje w dużej mierze niejasna. Wskazuje się na udział różnych mechanizmów, w tym zapalenia neurogennego, zaburzeń czucia mechanicznego oraz cytokin zapalnych.
Obraz opryszczkowatego zapalenia skóry
Opryszczkowate zapalenie skóry objawia się klinicznie jako polimorficzna wysypka grudkowo-pęcherzykowa, umiejscowiona symetrycznie na powierzchniach wyprostnych ciała. Zmiany skórne zwykle grupują się w sposób typowy dla opryszczki, z predylekcją do łokci, kolan, barków, pleców i pośladków. Inne często zajęte okolice to skóra owłosiona głowy, kark oraz okolica krzyżowa, natomiast rzadziej choroba obejmuje twarz i pachwiny.
Pojawienie się zmian na skórze zazwyczaj poprzedza uczucie świądu i pieczenia. W konsekwencji wielu pacjentów rozdrapuje wykwity, co prowadzi do powstania nadżerek, strupów i przeczosów maskujących pierwotne zmiany. Bardzo charakterystycznym objawem jest wyjątkowo intensywny świąd, niewspółmiernie silny w stosunku do widocznych zmian skórnych – jego brak wyraźnie przemawia za innym rozpoznaniem.
Rzadko można zaobserwować zajęcie jamy ustnej pod postacią pęcherzyków, nadżerek lub rumieniowych plam na błonie śluzowej jamy ustnej bądź na języku. Wśród innych nieprawidłowości opisuje się defekty szkliwa zębów stałych. Typowe są poziome bruzdy, dołeczki lub przebarwienia szkliwa.
Objawy ze strony przewodu pokarmowego, takie jak przemijające lub przewlekłe biegunki, zaparcia, wzdęcia, kurczowe bóle brzucha czy utrata masy ciała, występują u około 15–20% chorych. Pacjenci mogą także wykazywać zaburzenia wchłaniania, niedobór żelaza oraz spowolnione tempo wzrastania u dzieci. Można również obserwować inne pozajelitowe manifestacje celiakii, m.in. niepłodność, choroby wątroby, nefropatie, neuropatie czy ataksję móżdżkową.
Opryszczkowate zapalenie skóry często współwystępuje z wieloma innymi chorobami autoimmunologicznymi, z których najczęstsze to autoimmunologiczne choroby tarczycy oraz cukrzyca typu 1. Długotrwała choroba Duhringa zwiększa ryzyko rozwoju chłoniaków.
Choroba Duhringa – diagnozowanie i różnicowanie
Rozpoznanie opryszczkowatego zapalenia skóry opiera się na badaniu klinicznym w połączeniu z badaniami serologicznymi, immunofluorescencją i histopatologią. Bezpośrednia immunofluorescencja (DIF) jest złotym standardem w diagnostyce schorzenia. Badania histopatologiczne i serologiczne pełnią rolę badań uzupełniających w przypadkach wątpliwych.
Diagnostyka serologiczna
W surowicy chorych wykrywa się przeciwciała IgA skierowane przeciwko:
- endomysium mięśni gładkich (EmA),
- transglutaminazie tkankowej (tTG),
- transglutaminazie epidermalnej (eTG) – kluczowemu autoantygenowi; dodatkowo poziom IgA przeciwko eTG koreluje z aktywnością choroby i stopniem uszkodzenia jelita cienkiego.
Test ELISA dla przeciwciał IgA przeciw TG2 (tTG) jest szeroko dostępny, tani i łatwy do wykonania, a jego czułość w chorobie Duhringa sięga nawet 95%. Jednak przeciwciała anty-TG2 są mniej swoiste niż anty-TG3, ponieważ występują również u pacjentów z celiakią bez opryszczkowatego zapalenia skóry oraz z innymi chorobami skóry. Poziom przeciwciał anty-TG2 spada do normy u pacjentów przestrzegających diety bezglutenowej i wzrasta przy nawrocie choroby, co czyni ten test użytecznym w monitorowaniu przestrzegania diety. Około 20% pacjentów ma jednak ujemne wyniki dla przeciwciał anty-TG2 przy dodatnich anty-TG3. Nowe metody diagnostyczne oparte na serologii są wciąż rozwijane.
Immunofluorescencja
Immunofluorescencja bezpośrednia (DIF) pozostaje złotym standardem diagnostycznym. Czułość badania wynosi 90–95%, a swoistość sięga 95–100%. Biopsję należy pobierać z niezmienionej skóry sąsiadującej ze zmianą, ponieważ zawiera ona więcej złogów IgA. Biopsje pobrane ze zmian chorobowych częściej dają wyniki fałszywie ujemne. Patognomonicznym obrazem DIF są ziarniste złogi IgA w brodawkach skórnych i/lub wzdłuż połączenia skórno-naskórkowego.
Dieta bezglutenowa – w przeciwieństwie do leczenia farmakologicznego – obniża poziom IgA w skórze, co może wpływać na wynik DIF. Jeśli pacjent stosował dietę bezglutenową, zaleca się ponowną biopsję po miesiącu spożywania glutenu.
Histopatologia
Do badania pobiera się zmiany z nienaruszonym pęcherzem. W przypadku jego braku materiałem biopsyjnym jest skóra objęta rumieniem. Obraz histopatologiczny nie jest swoisty, a podobny wynik może występować np. w toczniu rumieniowatym pęcherzowym.
Diagnostyka różnicowa
W ramach diagnostyki różnicowej należy uwzględnić m.in. pęcherzycę, nabyte pęcherzowe oddzielanie się naskórka, świerzb oraz atopowe zapalenie skóry.
Leczenie choroby Duhringa
Podstawową terapią są dożywotnia dieta bezglutenowa oraz dapson. Restrykcje żywieniowe stanowią jedyną metodę przyczynową i powinny być wdrożone dopiero po zakończeniu pełnej diagnostyki. Inne opcje terapeutyczne, takie jak sulfasalazyna, silne miejscowe kortykosteroidy (np. walerianian betametazonu) czy leki przeciwhistaminowe, mają jedynie charakter objawowy – łagodzą dolegliwości skórne oraz świąd, nie wpływając na zmiany narządowe, dlatego nie mogą zastąpić diety bezglutenowej. Choć brak silnych dowodów naukowych na ich skuteczność, stanowią one główną linię leczenia w razie przeciwwskazań lub nietolerancji dapsonu.
Dieta bezglutenowa
Dieta bezglutenowa daje szybką poprawę kliniczną oraz zmniejsza ryzyko rozwoju chłoniaków. Zalecenia dietetyczne dotyczące żywienia bezglutenowego można znaleźć na stronie Narodowego Centrum Edukacji Żywieniowej. Całkowita eliminacja glutenu przy jednoczesnym zachowaniu zróżnicowania posiłków, aby zapobiegać niedoborom pokarmowym, może stanowić wyzwanie dla pacjenta, dlatego warto skierować go na konsultację dietetyczną.
Dapson
Dapson to najefektywniejszy lek objawowy, który działa w ciągu 3–4 dni. Jego odstawienie prowadzi do szybkiego nawrotu objawów. Jednak przed rozpoczęciem leczenia należy oznaczyć aktywność dehydrogenazy glukozo-6-fosforanowej (G6PD), a w trakcie terapii prowadzić regularną kontrolę laboratoryjną. Do działań niepożądanych dapsonu należą m.in. methemoglobinemia, niedokrwistość hemolityczna, neutropenia, bóle i zawroty głowy, zmęczenie, nudności oraz wymioty. Reakcje niepożądane występują częściej u osób starszych i z niedoborem G6PD.
Dawkowanie u dorosłych: początkowo 25 mg 1–2 razy/dobę, ze stopniowym zwiększaniem dawki do maks. 200 mg/dobę. Dawka podtrzymująca wynosi 0,5–1 mg/kg/dobę. W ciężkich przypadkach można rozpocząć od 50 mg 2–3 razy/dobę (po wykluczeniu niedoboru G6PD).
Dawkowanie u niemowląt i dzieci: 1–2 mg/kg/dobę (w 1–2 dawkach podzielonych), maks. 50 mg na dawkę. Dawka podtrzymująca zwykle wynosi 10–25% dawki początkowej.
Dapson, mimo że przenika przez łożysko w czasie ciąży, ogólnie uważa się za bezpieczny zarówno dla kobiety, jak i dla płodu. W okresie laktacji wydziela się do mleka i może powodować łagodną niedokrwistość hemolityczną u niemowląt. Zwykle nie stanowi jednak zagrożenia dla dzieci, o ile nie występuje u nich niedobór G6PD.
Źródła
- Didona, D., Maglie, R., & Solimani, F. (2025). Gluten-related skin disorders: Clinical presentation, diagnosis and treatments. Journal der Deutschen Dermatologischen Gesellschaft = Journal of the German Society of Dermatology, 23(7), 857–867. https://doi.org/10.1111/ddg.15704.
- Görög, A., Antiga, E., Caproni, M., Cianchini, G., De, D., Dmochowski, M., Dolinsek, J., Drenovska, K., Feliciani, C., Hervonen, K., Lakos Jukic, I., Kinyó, Á., Koltai, T., Korponay-Szabó, I., Marzano, A. V., Patsatsi, A., Rose, C., Salmi, T., Schmidt, E., Setterfield, J., … Sárdy, M. (2021). S2k guidelines (consensus statement) for diagnosis and therapy of dermatitis herpetiformis initiated by the European Academy of Dermatology and Venereology (EADV). Journal of the European Academy of Dermatology and Venereology, 35(6), 1251–1277. https://doi.org/10.1111/jdv.17183.
- Nguyen, C. N., & Kim, S. J. (2021). Dermatitis herpetiformis: An update on diagnosis, disease monitoring, and management. Medicina, 57(8), 843. https://doi.org/10.3390/medicina57080843.



