Wyszukaj w publikacjach

Endometrioza jest przewlekłą, zapalną chorobą ginekologiczną dotykającą około 10% kobiet w wieku rozrodczym na całym świecie, co odpowiada około 190 milionom osób. Choć uznawana jest za jednostkę łagodną, jej potencjalna transformacja nowotworowa, zwłaszcza w jajniku, pozostaje przedmiotem licznych badań.
Patofizjologia i obraz kliniczny endometriozy
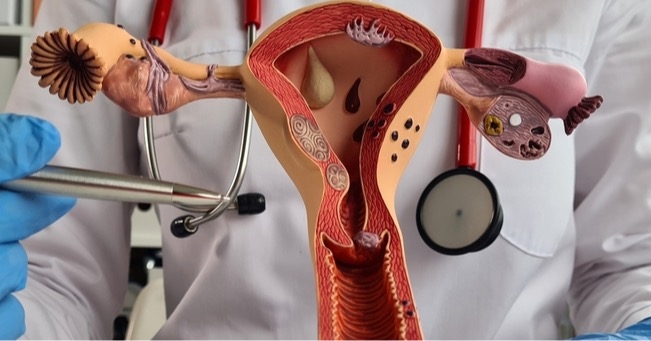
Endometrioza charakteryzuje się obecnością czynnych ognisk tkanki endometrialnej poza jamą macicy – najczęściej w obrębie:
- jajników,
- otrzewnej miednicy mniejszej,
- przegrody odbytniczo-pochwowej,
- więzadeł krzyżowo-macicznych,
- powierzchni jelit.
Mimo łagodnego charakteru histologicznego, ogniska endometriozy wykazują cechy biologiczne zbliżone do zmian nowotworowych:
- zdolność do naciekania sąsiednich tkanek,
- indukowania odpowiedzi zapalnej,
- tworzenia mikrośrodowiska bogatego w cytokiny i reaktywne formy tlenu,
- oporność na apoptozę.
Patogeneza choroby jest złożona i wieloczynnikowa. Obok klasycznej teorii wstecznej menstruacji, coraz większego znaczenia nabierają mechanizmy epigenetyczne, immunologiczne i genetyczne.
Obraz kliniczny endometriozy jest niezwykle zróżnicowany i nie zawsze koreluje ze stopniem zaawansowania choroby. Do najczęstszych objawów należą:
- bolesne miesiączkowanie (dysmenorrhoea),
- przewlekły ból miednicy mniejszej,
- ból podczas stosunku (dyspareunia),
- ból podczas oddawania moczu i stolca (dysuria, dyschezja),
- niepłodność.
W przypadkach głęboko naciekającej endometriozy możliwe są również objawy związane z naciekaniem pęcherza moczowego, jelita grubego lub struktur nerwowych. Choroba wpływa istotnie na jakość życia pacjentek oraz wiąże się z wieloletnim opóźnieniem diagnostycznym – średnio 7 lat od wystąpienia pierwszych objawów.
Endometrioza a nowotwory
Najsilniej udokumentowany jest związek między endometriozą a rakiem jajnika, zwłaszcza jego dwiema specyficznymi postaciami histopatologicznymi:
- rakiem jasnokomórkowym (clear cell carcinoma, CCC),
- rakiem endometrioidalnym (endometrioid carcinoma, EC).
Na podstawie kryteriów Sampsona (1925) oraz rozszerzenia zaproponowanego przez Scotta (1953), wyróżnia się dwa pojęcia:
- rak jajnika związany z endometriozą (endometriosis-associated ovarian cancer, EAOC),
- rak jajnika rozwijający się w endometriozie (ovarian cancer arising in endometriosis, OCAE).
Oba typy nowotworów występują najczęściej u kobiet w wieku przedmenopauzalnym i zwykle diagnozowane są w niskich stadiach zaawansowania klinicznego (FIGO I–II), co może wpływać na stosunkowo korzystne rokowanie.
W metaanalizach ryzyko rozwoju CCC u kobiet z endometriozą jest blisko 3,5-krotnie wyższe, a EC około 2,3-krotnie wyższe w porównaniu do populacji ogólnej. Około 60–80% przypadków EAOC/OCAE współistnieje z tzw. atypową endometriozą, która uznawana jest za stan przednowotworowy.
Poza rakiem jajnika, niektóre badania wskazują także na:
- umiarkowany wzrost ryzyka raka tarczycy,
- nieistotnie statystyczny związek z rakiem endometrium,
- minimalny związek z rakiem piersi,
- zmniejszone ryzyko w przypadku raka szyjki macicy – co może wynikać z częstszej diagnostyki cytologicznej u pacjentek z endometriozą.
Pomimo tych obserwacji, należy podkreślić, że transformacja nowotworowa pozostaje zjawiskiem rzadkim i dotyczy niewielkiego odsetka kobiet z endometriozą.
W związku z powyższym, za fakt należy uznać potrzebę monitorowania pacjentek z endometriozą, ale mitem jest postrzeganie endometriozy jako stanu przednowotworowego.
Molekularne cele leczenia raka jajnika powiązanego z endometriozą
W obliczu rosnącej wiedzy na temat molekularnych podstaw transformacji nowotworowej endometriozy, coraz większego znaczenia nabierają strategie terapeutyczne oparte na precyzyjnym oddziaływaniu na określone szlaki komórkowe i immunologiczne. Raki jajnika związane z endometriozą charakteryzują się unikalnym profilem molekularnym, często obejmującym mutacje w genach ARID1A, PIK3CA, PTEN oraz zaburzenia regulacji szlaku PI3K/AKT/mTOR. Te molekularne cechy otwierają drogę do zastosowania terapii celowanych, m.in.:
- inhibitorów mTOR (np. ewerolimus),
- inhibitorów PI3K,
- eksperymentalnych leków przywracających funkcję kompleksu SWI/SNF w przypadkach mutacji ARID1A.
Niemniej jednak, skuteczność terapii celowanych i immunoterapii w EAOC i OCAE wymaga dalszej walidacji w badaniach z randomizacją. Kluczowe pozostaje także opracowanie biomarkerów predykcyjnych odpowiedzi oraz lepsze zrozumienie heterogenności molekularnej tych nowotworów. W przyszłości terapie spersonalizowane mogą stanowić istotne uzupełnienie standardowego leczenia chirurgiczno-chemioterapeutycznego, zwłaszcza u pacjentek z nawrotami choroby lub opornością na chemioterapię platynową.
Znaczenie kliniczne i rekomendacje dotyczące postępowania
Zidentyfikowanie potencjalnego związku między endometriozą a wybranymi typami nowotworów, w szczególności rakiem jajnika, ma istotne znaczenie kliniczne, jednak nie powinno prowadzić do nadrozpoznawalności ani nieuzasadnionych interwencji chirurgicznych. Kluczowym elementem postępowania pozostaje indywidualizacja oceny ryzyka, ze szczególnym uwzględnieniem takich czynników jak:
- obecność endometriozy jajnikowej (endometrioma),
- zmiany atypowe w badaniu histopatologicznym,
- szybki wzrost torbieli,
- oporność na leczenie hormonalne,
- występowanie mutacji w genach związanych z transformacją nowotworową – ARID1A, PIK3CA, PTEN.
Obecnie nie istnieją oficjalne rekomendacje dotyczące rutynowego wykonywania badań przesiewowych w kierunku nowotworów u wszystkich pacjentek z endometriozą. Niemniej jednak, w przypadku kobiet z torbielami endometrialnymi o niejasnym obrazie ultrasonograficznym, zmianami rosnącymi w czasie lub dodatnim wywiadem rodzinnym w kierunku nowotworów ginekologicznych, wskazane jest zwiększenie czujności klinicznej.
W sytuacjach wątpliwych, rekomenduje się:
- rozszerzoną diagnostykę obrazową (preferencyjnie rezonans magnetyczny),
- oznaczanie markerów nowotworowych (np. CA-125),
- rozważenie wczesnej kwalifikacji do leczenia operacyjnego w ośrodkach specjalistycznych.
Z punktu widzenia prewencji wtórnej, istotne jest także prowadzenie długoterminowego nadzoru nad pacjentkami po leczeniu operacyjnym endometriozy jajnikowej, szczególnie jeśli usunięte zmiany wykazywały cechy atypii. Edukacja pacjentek odgrywa kluczową rolę – należy dostarczać rzetelnych informacji o rzeczywistym, relatywnie niskim ryzyku transformacji nowotworowej oraz uświadamiać znaczenie regularnych kontroli ginekologicznych i samoobserwacji objawów.
Źródła
- Kedzia, M., Basta, P., Czajkowski, K., Gogacz, M., Spaczynski, R., Mroczkowska, B., Stojko, R., Szaflik, T., Szubert, M., Szyllo, K., Zaborowski, M., & Sieroszewski, P. (2024). Guidelines of the Polish Society of Gynecologists and Obstetricians on the management of women with endometriosis. Ginekologia Polska, 95(9), 729–758. https://doi.org/10.5603/gpl.100261
- Rahmioglu, N., Mortlock, S., Ghiasi, M., Møller, P. L., Stefansdottir, L., Galarneau, G., Turman, C., Danning, R., Law, M. H., Sapkota, Y., Christofidou, P., Skarp, S., Giri, A., Banasik, K., Krassowski, M., Lepamets, M., Marciniak, B., Nõukas, M., Perro, D., Sliz, E., … Zondervan, K. T. (2023). The genetic basis of endometriosis and comorbidity with other pain and inflammatory conditions. Nature genetics, 55(3), 423–436. https://doi.org/10.1038/s41588-023-01323-z
- Chiaffarino, F., Cipriani, S., Ricci, E., Esposito, G., Parazzini, F., & Vercellini, P. (2024). Histologic Subtypes in Endometriosis-Associated Ovarian Cancer and Ovarian Cancer Arising in Endometriosis: A Systematic Review and Meta-Analysis. Reproductive sciences (Thousand Oaks, Calif.), 31(6), 1642–1650. https://doi.org/10.1007/s43032-024-01489-9
- Kvaskoff, M., Mahamat-Saleh, Y., Farland, L. V., Shigesi, N., Terry, K. L., Harris, H. R., Roman, H., Becker, C. M., As-Sanie, S., Zondervan, K. T., Horne, A. W., & Missmer, S. A. (2021). Endometriosis and cancer: a systematic review and meta-analysis. Human reproduction update, 27(2), 393–420. https://doi.org/10.1093/humupd/dmaa045