Wyszukaj w publikacjach
Wytyczne w pigułce: diagnostyka i leczenie zaburzeń lipidowych

Dyslipidemia to niezwykle powszechny, a przy tym najgorzej kontrolowany czynnik ryzyka choroby sercowo-naczyniowej w Polsce. W odpowiedzi na wyzwania związane z diagnostyką i terapią tego schorzenia powstały wytyczne stanowiące efekt pracy aż sześciu towarzystw naukowych! W poniższym artykule znajdziecie streszczenie tego dokumentu, które z pewnością przyda się zarówno w codziennej praktyce klinicznej, jak i podczas nauki do egzaminów.
Przy wybranych rekomendacjach umieszczono oznaczenia klasy zaleceń i poziomu wiarygodności danych zapisane w formie nawiasu (klasa, poziom) np. (I, A).
1. Profil lipidowy
Celem oceny ryzyka sercowo-naczyniowego, należy oznaczyć profil lipidowy uwzględniający stężenie: cholesterolu całkowitego (TC), cholesterolu HDL (HDL-C), cholesterolu LDL (LDL-C), triglicerydów (TG), cholesterolu nie-HDL (nie-HDL-C).
Badanie przesiewowe w kierunku dyslipidemii powinno być wykonywane u:
- mężczyzn >40. r.ż.,
- mężczyzn z zaburzeniami erekcji,
- kobiet >50. r.ż.,
- kobiet po menopauzie,
- kobiet z cukrzycą ciężarnych i/lub nadciśnieniem tętniczym w ciąży,
- pacjentów z ≥1 czynnikiem ryzyka sercowo-naczyniowego (np. nadciśnieniem tętniczym, otyłością, uzależnieniem od tytoniu, obciążonym wywiadem rodzinnym),
- osób zakażonych HIV lub w trakcie terapii HAART,
- chorych z rozpoznaną: chorobą sercowo-naczyniową, hipercholesterolemią rodzinną, rodzinnym obciążeniem przedwczesnymi chorobami sercowo-naczyniowymi, cukrzycą, przewlekłą chorobą nerek, chorobami o podłożu autoimmunologicznym, reumatologicznym i zapalnym.
W niektórych przypadkach należy oznaczyć także stężenie:
- apolipoproteiny B (apoB) – jako miary zawartości cząstek LDL w osoczu/surowicy i czynnik ryzyka sercowo-naczyniowego; parametr ten stanowi alternatywę dla oszacowania stężenia LDL-C, gdy jego dokładność jest obniżona,
- szczególnie u osób ze stężeniem TG >4,5 mmol/l (400 mg/dl) [od redakcji: według wytycznych PTDL/PTL 2024 – TG>2,3 mmol/l (200 mg/dl)], otyłością, cukrzycą, zespołem metabolicznym i niskim stężeniem triglicerydów i cholesterolu LDL (I, C),
- lipoproteiny (a) (Lp (a)) – raz w życiu u każdej osoby dorosłej (IIa, C), a w szczególności:
- u osób z przedwcześnie występującą chorobą sercowo-naczyniową,
- przy braku oczekiwanego efektu leczenia statyną,
- w razie potrzeby lepszej stratyfikacji ryzyka u osób o granicznym ryzyku między umiarkowanym i dużym (IIa, C),
- osób z miażdżycową chorobą sercowo-naczyniową (ASCVD) i/lub hipercholesterolemią rodzinną (FH),
- kobiet w ciąży (IIb, C).
Co warto mieć na uwadze?
- Próbki krwi do badania profilu lipidowego nie muszą być pobierane na czczo, należy rozważyć powtórzenie badań na czczo w przypadku stężenia TG >5 mmol/l (440 mg/dl).
- Dyslipidemia aterogenna charakteryzuje się zwiększonym stężeniem TG i LDL oraz zmniejszonym HDL.
- Wytyczne podkreślają, że rekomendowane jest wyliczanie cholesterolu nie-HDL-C za każdym razem, gdy wykonywany jest profil lipidowy, ponieważ jego stężenie najlepiej obrazuje zawartość wszystkich lipoprotein aterogennych. W szczególności parametr ten należy wziąć pod uwagę u osób ze stężeniem TG >4,5 mmol/l (>400 mg/dl) [od redakcji: według wytycznych PTDL/PTL 2024 – TG>2,3 mmol/l (200 mg/dl)], otyłością, cukrzycą, zespołem metabolicznym oraz niskim stężeniem TC i LDL-C.
Stężenie LDL-C jest podstawowym parametrem służącym do oceny ryzyka sercowo-naczyniowego, a jego obniżenie jest podstawowym celem leczenia hipolipemizującego (I, A).
Oceniając wyniki laboratoryjne pacjenta, warto skorzystać z przeliczników jednostek: cholesterolu i triglicerydów oraz gospodarki węglowodanowej i lipidowej.
2. Ocena ryzyka sercowo-naczyniowego i cele terapii hipolipemizującej
Wytyczne leczenia zaburzeń lipidowych wskazują na ocenę ryzyka sercowo-naczyniowego w celu prewencji pierwotnej zgodnie ze skalą POL-SCORE 2015 (I, A). W późniejszym czasie eksperci z European Society of Cardiology przygotowali nową, odświeżoną wersję algorytmu – SCORE2, także dla ludzi starszych (SCORE2-OP) oraz chorujących na cukrzycę typu 2 (SCORE2-diabetes).
Zgodnie z rekomendacjami, pacjentów można przydzielić do poszczególnych kategorii całkowitego ryzyka sercowo-naczyniowego w przypadku wystąpienia co najmniej jednego z przypisanych czynników ryzyka.
W poniższej tabeli zebrano powyższe dane w zestawieniu z celami terapii hipolipemizującej.
| Ryzyko | Czynniki | LDL-C | nie-HDL-C |
|---|---|---|---|
Ekstremalne | – pacjent w prewencji pierwotnej z POL-SCORE >20%; – stan po OZW i innym incydencie naczyniowym w ciągu ostatnich 2 lat w wywiadzie; – stan po OZW i występowanie choroby naczyń obwodowych lub choroby wielołożyskowej (inaczej miażdżycy wielopoziomowej, tj. występowanie istotnych zmian miażdżycowych w co najmniej dwóch z trzech łożysk naczyniowych: naczynia wieńcowe, tętnice dogłowowe, naczynia obwodowe); – stan po OZW i współistniejąca wielonaczyniowa choroba wieńcowa – stan po OZW oraz hipercholesterolemia rodzinna (FH); – stan po OZW u pacjenta z cukrzycą i co najmniej jednym dodatkowym czynnikiem ryzyka: podwyższone Lp(a) >50 mg/dl, hsCRP >3 mg/l, przewlekła choroba nerek. | <40 mg/dl (<1,0 mmol/l) | <70 mg/dl (<1,8 mmol/l) |
Bardzo duże | – udokumentowana klinicznie lub w badaniach obrazowych choroba sercowo-naczyniowa; – cukrzyca typu 2 z uszkodzeniem narządowym (występowanie mikroalbuminurii, retinopatii, neuropatii lub uszkodzenia mięśnia lewej komory serca) lub z co najmniej dwoma dużymi czynnikami ryzyka; – cukrzyca typu 1 o wczesnym początku trwająca >20 lat; – przewlekła choroba nerek z eGFR <30 ml/min/1,73 m2; – rodzinna hipercholesterolemia (FH) z CVD lub innym dużym czynnikiem ryzyka; – ryzyko ≥10% i ≤20% wg skali POL-SCORE. Duże czynniki ryzyka to: – wiek ≥65 lat; – nadciśnienie tętnicze; – dyslipidemia; – palenie tytoniu; – otyłość. | <55 mg/dl (<1,4 mmol/l) oraz obniżenie wyjściowegocholesterolu LDL-C ≥50% | <85 mg/dl (<2,2 mmol/l) |
Duże | znacznie nasilony pojedynczy czynnik ryzyka, szczególnie: – cholesterol całkowity >8 mmol/l (>310 mg/dl), – cholesterol LDL >4,9 mmol/l (>190 mg/dl), – ciśnienie tętnicze krwi ≥180/110 mmHg, hipercholesterolemia rodzinna bez innych czynników ryzyka cukrzyca bez uszkodzenia narządowego (bez względu na czas trwania) – nie dotyczy cukrzycy typu 1 u dorosłych poniżej 35. r.ż. z czasem trwania cukrzycy <10 lat, przewlekła choroba nerek z eGFR 30-59 ml/min/1,73 m2ryzyko ≥5% i <10% wg skali POL-SCORE | <70 mg/dl (<1,8 mmol/l) oraz obniżenie wyjściowegocholesterolu LDL-C ≥50% | <100 mg/dl (<2,5 mmol/l) |
Umiarkowane | ryzyko <5% wg skali POL-SCORE | <100 mg/dl (<2,5 mmol/l) | <130 mg/dl (<3,4 mmol/l) |
Małe | ryzyko <1% wg skali POL-SCORE | <115 mg/dl (<3 mmol/l) | – |
3. Metody profilaktyki i terapii zaburzeń lipidowych
Metody niefarmakologiczne
Modyfikacja stylu życia zalecana jest u wszystkich pacjentów (I, A). Wśród nawyków, jakie należy rekomendować, wymienia się:
- obniżenie spożycia nasyconych kwasów tłuszczowych do <10% spożywanych kalorii (<7% u osób z hipercholesterolemią) – im mniej, tym lepiej (I, B);
- obniżenie spożycia nienasyconych kwasów tłuszczowych typu trans pochodzenia naturalnego do <1% spożywanych kalorii i niespożywanie nienasyconych kwasów tłuszczowych typu trans pochodzenia przemysłowego (I, C);
- spożywanie co najmniej 200 g owoców i 200 g warzyw dziennie (I, C);
- spożywanie ryb co najmniej 1-2 w tygodniu (I, C);
- regularna aktywność fizyczna – o umiarkowanej intensywności (nie mniej niż 30 minut dziennie); każde zwiększenie intensywności wysiłku zmniejsza ryzyko zgonu (I, C);
- spożycie 25-40 g błonnika (w tym co najmniej 7-13 g błonnika rozpuszczalnego), który aktywnie redukuje wchłanianie jelitowe tłuszczów.
Celem redukcji LDL-C, eksperci rekomendują także tak zwaną żywność funkcjonalną, czyli nutraceutyki – większość z nich wpływa nie tylko na profil lipidowy, ale także na stężenie glukozy w osoczu, insulinooporność, sztywność naczyń, ciśnienie tętnicze krwi, stany zapalne czy nawet stres oksydacyjny.
W poniższej tabeli zebrano najważniejsze elementy postępowania niefarmakologicznego z uwzględnieniem ich wpływu na poszczególne parametry profilu lipidowego.
| Postępowanie | TC, LDL-C/nie-HDL-C | TG | HDL-C |
|---|---|---|---|
Zmniejszenie spożycia tłuszczów trans | +++ | – | +++ |
Zmniejszenie spożycia tłuszczównasyconych | +++ | – | – |
Zmniejszenie spożycia tłuszczów w diecie | + | – | – |
Zwiększenie spożycia błonnika | ++ | – | – |
Zastosowanie żywności funkcjonalnejz fitosterolami | ++ | – | – |
Zmniejszenie spożycia alkoholu | – | +++ | – |
Regularna aktywność fizyczna | + | ++ | +++ |
Zmniejszenie spożycia jedno- i dwucukrów | – | ++ | – |
Redukcja nadmiernej masy ciała | ++ | +++ | ++ |
Zastosowanie suplementów zawierającychczerwony ryż drożdżowy (monakolina K) | +++ | – | — |
Zastosowanie suplementów zawierającychkwasy omega-3 | – | +++ | – |
Zaprzestanie palenia tytoniu | – | – | + |
+++ zauważalny wpływ, ++ mniej wyrażony wpływ, + niewielki wpływ oraz – brak wpływu.
Metody farmakologiczne
- Statyny – leki pierwszego rzutu:
- wpływają przede wszystkim na stężenie LDL-C, w mniejszym stopniu TG;
- największe zastosowanie mają atorwastatyna (bezpieczna u chorych z przewlekłą niewydolnością nerek) oraz rozuwastatyna (preferowana u osób starszych w umiarkowanych dawkach – najwyższy profil bezpieczeństwa), choć od 2021 roku dostępna na rynku jest także pitawastatyna.
- Ezetymib:
- w skojarzeniu z intensywną terapią statynami może redukować LDL-C nawet o 65-70%, w mniejszym stopniu wpływa na TG i HDL,
- ezetymib w monoterapii należy rozważyć u pacjentów, którzy nie tolerują statyn,
- przeciwwskazany u pacjentów z zaburzeniami czynności wątroby,
- zaburza wchłanianie steroli i stanoli roślinnych.
- Inhibitory PCSK9 – program lekowy B.101.
- Fibraty – fenofibrat:
- redukują stężenie TG i zwiększają HDL,
- wskazane głównie w przypadku ciężkiej hipertriglicerydemii oraz u pacjentów z utrzymującą się hipertriglicerydemią (TG >200 mg/dl lub >2,3 mmol/l) pomimo leczenia statyną.
- Kwasy omega-3:
- redukują stężenie TG (do 20-30%),
- można rozważyć wdrożenie u pacjentów (w dawce ≥2 g) z utrzymującymi się TG >200 mg/dl lub >2,3 mmol/l, pomimo leczenia statyną i fibratem.
- Żywice jonowymienne:
- w dawkach maksymalnych: cholestyramina 24 g/dobę, kolestipol 20 g/dobę lub kolesewelam 4,5 g/dobę, zmniejszają stężenie LDL-C o 18-25%,
- u niektórych pacjentów mogą zwiększać stężenie TG,
- bezpieczne dla kobiet w ciąży i w okresie karmienia.
- Kwas bempediowy:
- redukuje stężenie LDL-C,
- jego zastosowanie można rozważyć u pacjentów z ASCVD lub FH i bardzo wysokim ryzykiem sercowo-naczyniowym, którzy nie osiągają celów terapeutycznych przy intensywnym leczeniu statyną i ezetymibem. Może być również skuteczny u pacjentów z nietolerancją statyn (np. w skojarzeniu z ezetymibem).
- Inne, nowe leki hipolipemizujące:
- apabetalon,
- ewinakumab,
- antysensowne oligonukleotydy, np. wolanesorsen.
Afereza LDL
Afereza LDL jest mechaniczną metodą usuwania cząstek LDL – trwa 2-4 godziny i pozwala na redukcję LDL-C o 55-70%. W trakcie zabiegu z osocza filtrowane są również: VLDL, fibrynogen, Lp(a), α2-makroglobulina, czynniki krzepnięcia.
Afereza rekomendowana jest m.in.:
- pacjentom z homozygotyczną hipercholesterolemią rodzinną,
- chorym, u których farmakoterapia nie przynosi efektów lub jest przeciwwskazana,
- osobom z ciężką mieszaną hiperlipidemią.
Dokładne wskazania do wykonania tego zabiegu można znaleźć w stanowisku Grupy Roboczej Polskiego Towarzystwa Nefrologicznego ds. Aferezy.
Strategie postępowania
Podstawowe zasady postępowania u pacjentów z dyslipidemią
- U wszystkich pacjentów należy zalecić modyfikację stylu życia (I, A).
- Złotym standardem terapii hipolipemizującej są statyny – zaleca się przepisywanie preparatów o wysokiej intensywności (np. atorwastatyna i rozuwastatyna) do najwyższej tolerowanej dawki (I, A).
- Jeżeli cele terapii nie zostaną osiągnięte, zaleca się skojarzenie statyn z ezetymibem (I, B).
- W przypadku dalszych niepowodzeń, należy rozważyć dołączenie inhibitora PCSK9.
| Grupa ryzyka | Rekomendowana terapia |
|---|---|
Ekstremalne | Ekstremalnie intensywna terapia hipolipemizująca (spadek LDL o 80-85%) – atorwastatyna 40-80 mg/d + alirokumab/ewolokumab – rozuwastatyna 20-40 mg/d + alirokumab/ewolokumab – atorwastatyna 40-80 mg/d + ezetymib 10 mg/d + alirokumab/ewolokumab – rozuwastatyna 20-40 mg/d + ezetymib 10 mg/d + alirokumab/ewolokumab – atorwastatyna 40-80 mg/d + inklisiran 300 mg co 3-6 miesięcy – rozuwastatyna 20-40 mg/d + inklisiran 300 mg co 3-6 miesięcy |
Bardzo duże | Bardzo intensywna terapia hipolipemizująca (spadek LDL-C 60-80%) – atorwastatyna 40-80 mg/d + ezetymib 10 mg/d – rozuwastatyna 20-40 mg/d + ezetymib 10 mg/d – atorwastatyna 40-80 mg/d + ezetymib 10 mg/d + kwas bempediowy 180 mg/d – rozuwastatyna 20-40 mg/d + ezetymib 10 mg/d + kwas bempediowy 180 mg/d – rozuwastatyna 10 mg + ezetymib 10 mg/d + kwas bempediowy 180 mg/d – atorwastatyna 20 mg + ezetymib 10 mg/d + kwas bempediowy 180 mg/d – alirokumab 150 mg co 2 tygodnie – ewolokumab 140 mg co 2 tygodnie – rozuwastatyna 5-10 mg/d (+ ezetymib 10 mg/d) + alirokumab/ewolokumab/inklisiran – atorwastatyna 10-20 mg/d (+ ezetymib 10 mg/d) + alirokumab/ewolokumab/inklisiran |
Duże | Intensywna terapia hipolipemizująca (spadek LDL-C o 50-60%) – atorwastatyna 40-80 mg/d – rozuwastatyna 20-40 mg/d – rozuwastatyna 5-10 mg/d + ezetymib 10 mg/d – atorwastatyna 10-20 mg/d + ezetymib 10 mg/d – pitawastatyna 4 mg + ezetymib 10 mg/d |
Umiarkowane | Umiarkowanie intensywna terapia hipolipemizująca (spadek LDL-C o 30-50%) – rozuwastatyna 5-10 mg/d – atorwastatyna 10-20 mg/d – pitawastatyna 4 mg/d – pitawastatyna 1-2 mg + ezetymib 10 mg/d |
Małe ryzyko | Nisko intensywna terapia hipolipemizująca (spadek LDL-C <30%) – pitawastatyna 1 mg/d |
W codziennej praktyce klinicznej wyzwaniem może być decyzja, kiedy rozpocząć farmakoterapię u pacjentów z małym ryzykiem sercowo-naczyniowym. Autorzy wytycznych rekomendują, aby w przypadku braku efektów terapeutycznych zrobić to najpóźniej po 6 miesiącach od wdrożenia modyfikacji stylu życia. Pacjentom można zalecić np. nutraceutyki (najlepiej w formie polypill), małą dawkę statyn lub, w przypadku ich nietolerancji, ezetymib, a w dalszej kolejności połączenie powyższych terapii.
Proponowany schemat postępowania:
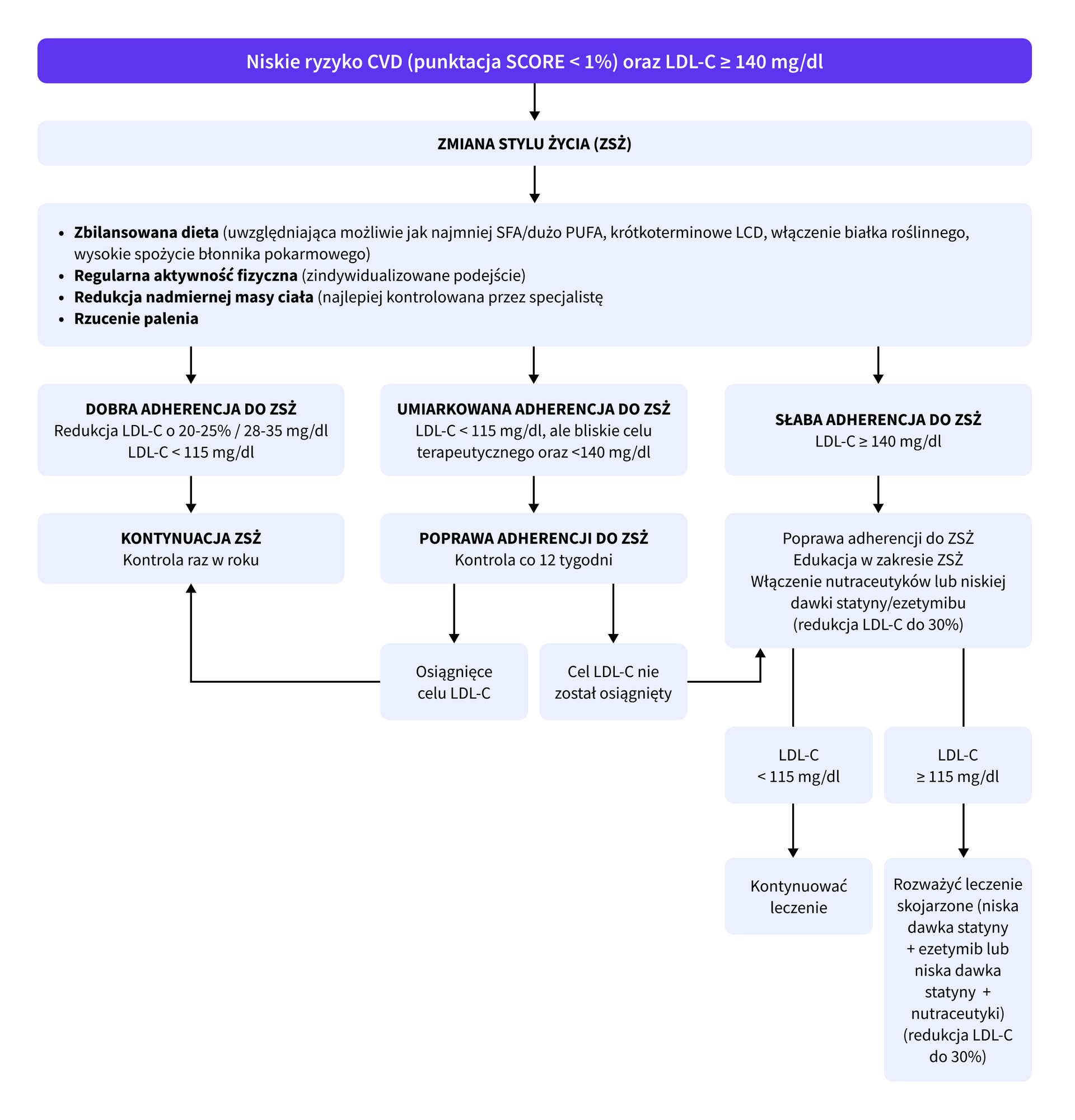
Kolejnym dylematem może być czas wdrożenia terapii skojarzonej. Według wytycznych ESC/EAS 2019, w przypadku niepowodzeń terapeutycznych u pacjentów z dużym oraz bardzo dużym ryzykiem sercowo-naczyniowym leczonych statynami w maksymalnych dawkach, po 4-6 tygodniach zaleca się dodanie ezetymibu. A w przypadku dalszych niepowodzeń, po kolejnych 4-6 tygodniach inhibitorów białka PCSK9.
Autorzy wytycznych wspominają również o grupach pacjentów, u których rozważyć można natychmiastowe wdrożenie terapii skojarzonej z ezetymibem, m.in.:
- pacjentów bardzo dużego ryzyka z wyjściowym stężeniem cholesterolu LDL, który uniemożliwia osiągnięcie celu terapeutycznego w wyniku monoterapii statynami (czyli np. u pacjentów z LDL-C >120 mg/dl (>3,1 mmol/l), zakładając, że intensywne leczenie obniża stężenie LDL-C o ok. 50%),
- pacjentów w grupie ekstremalnego ryzyka sercowo-naczyniowego.
Nietolerancja statyn
Według rekomendacji International Lipid Expert Panel (ILEP), nietolerancja statyn rozumiana jest jako brak możliwości optymalnej terapii w stosunku do istniejącego ryzyka sercowo-naczyniowego:
- niemożność tolerowania co najmniej 2 statyn – jednej w najmniejszej początkowej dawce na dobę i drugiej w każdej dostępnej dawce,
- nietolerancja związana z potwierdzonymi objawami niepożądanymi związanymi ze stosowaniem statyn i/lub istotnym wzrostem markerów (kinazy kreatynowej),
- zjawisko dechallenge – poprawa objawów klinicznych i/lub parametrów biochemicznych po zmniejszeniu dawki statyny lub przerwaniu terapii,
- występowanie objawów klinicznych i/lub zmiana parametrów biochemicznych niezwiązane z innymi czynnikami i chorobami zwiększającymi ryzyko wystąpienia nietolerancji statyn, w tym z interakcjami lekowymi.
Objawy pojawiają się w 90% w pierwszych 6 miesiącach od rozpoczęcia terapii lub zwiększenia dawki statyny, w 75% jest to pierwsze 12 tygodni. Nietolerancja występująca po roku rozpoczęcia leczenia najczęściej wynika z pojawienia się nowych czynników ryzyka lub zmiany dawkowania.
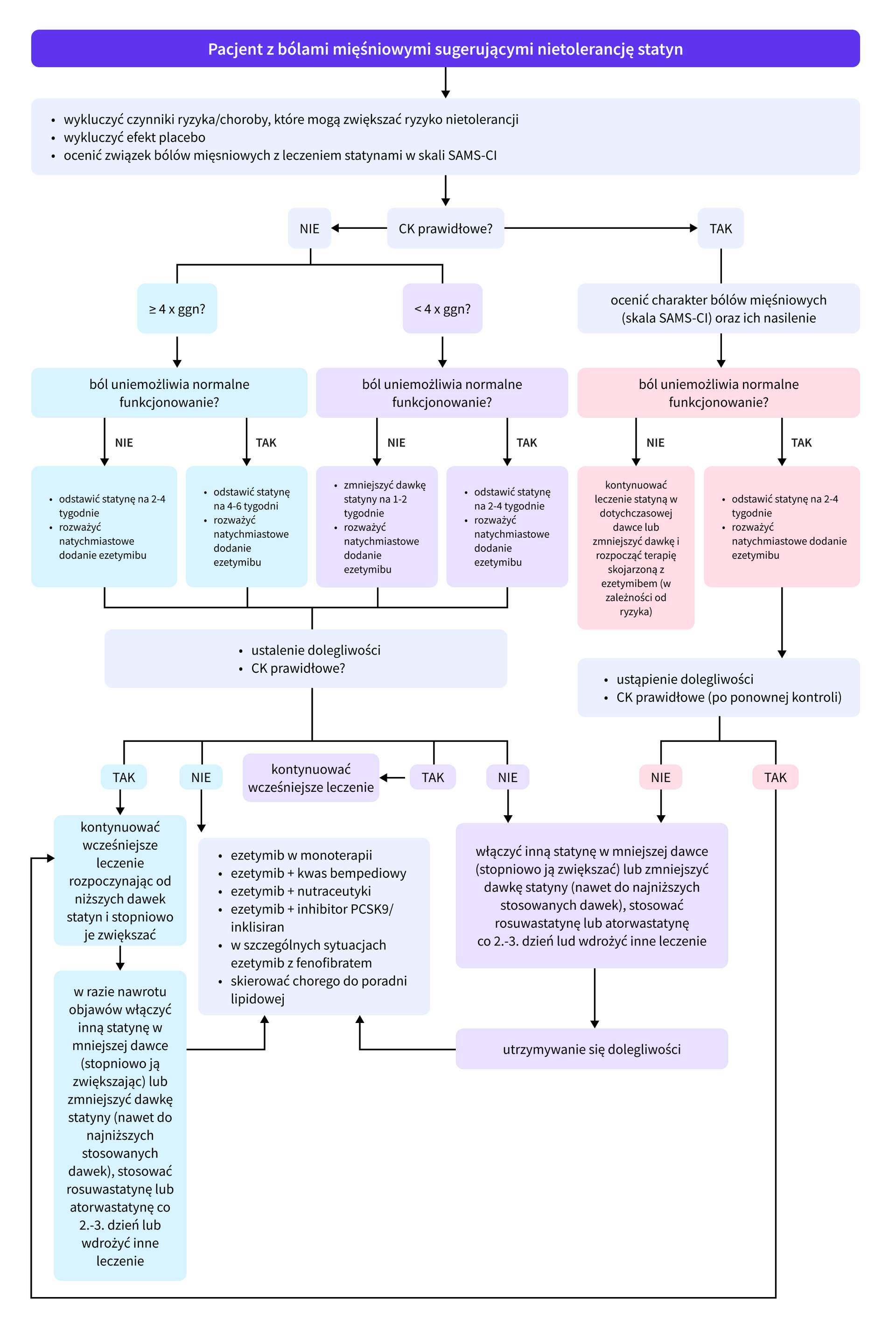
Postępowanie:
- step by step approach – dokładne badanie podmiotowe, stopniowe wykluczanie powodów nietolerancji i szybkie wdrożenie odpowiedniej terapii;
- ocena, czy bóle mięśniowe związane są ze stosowaniem statyn z pomocą skali SAMS – Clinical Index,
- dążenie do zachowania najmniejszej tolerowanej dawki statyny i/lub stosowania jej nawet co 2-3 dni (dotyczy atorwastatyny i rozuwastatyny),
- w przypadku pełnej nietolerancji statyn – szczególnie u pacjentów wysokiego ryzyka – natychmiastowe włączenie ezetymibu i innych dostępnych terapii niestatynowych,
- pitawastatyna ze względu na swój metabolizm i właściwości ma potencjalnie najniższe ryzyko wystąpienia nietolerancji.
Monitorowanie lipidów oraz parametrów biochemicznych
Badanie profilu lipidowego
Przed rozpoczęciem terapii: dwukrotnie (z wyjątkiem OZW) w odstępach 1-12 tygodni.
W trakcie terapii: co 6-12 miesięcy oraz po 6 (+/-4) tygodniach od zmiany leczenia hipolipemizującego, aż do osiągnięcia docelowych stężeń.
Parametry biochemiczne
Przed rozpoczęciem farmakoterapii statynami należy oznaczyć:
- CK (nie rozpoczyna się leczenia statyną, jeżeli CK ≥4 x ggn),
- ALT (nie rozpoczyna się leczenia statyną, jeżeli ALT ≥3 x ggn),
- stężenie glukozy i HbA1c – ze względu na potencjał diabetogenny statyn, należy rozważyć u pacjentów z dużym ryzykiem cukrzycy, chorych w podeszłym wieku, osób otyłych oraz z zespołem metabolicznym.
W trakcie terapii statynami:
- ALT – eksperci europejscy zalecają oznaczenie po 8-12 tygodniach od rozpoczęcia leczenia i po zwiększeniu dawki, a później tylko w przypadku niepokojących objawów:
- <3 x ggn – kontynuacja terapii i powtórne badanie po 4-6 tyg.,
- ≥3 x ggn – przerwanie terapii lub zmniejszenie dawki i powtórzenie badania po 4 tyg. – w przypadku powrotu do normy stopniowe wprowadzanie leczenia.
- CK – pomiar w przypadku wystąpienia objawów mięśniowych. Leczenie statyną można kontynuować w przypadku wartości CK:
- <4 x ggn – monitorowanie objawów i regularne badanie CK; gdy objawy utrzymują się, należy przerwać leczenie i ocenić stan pacjenta po 2-4 tygodniach;
- 4-10 x ggn u pacjentów bez objawów mięśniowych (przypadkowe wykrycie) – należy monitorować CK co 2 tyg. i wykluczyć wzrost idiopatyczny.
- Leczenie statyną należy przerwać, jeśli CK wynosi:
- >10 x ggn – dodatkowo ocenić funkcję nerek i monitorować CK co 2 tygodnie.
- 4-10 x ggn u pacjentów z objawami mięśniowymi – ocenić symptomy po 2-4 tyg. od przerwania terapii i ponownie rozważyć wskazania do włączenia statyn.
- CK w normie, ale nietolerowane objawy mięśniowe.
- stężenie glukozy i HbA1C – w populacjach jak powyżej.
Warto również pamiętać, że w przypadku fibratów, przed rozpoczęciem leczenia należy ocenić ALT, CK oraz kreatyninę, a w trakcie terapii regularnie kontrolować ALT.
Wybrane sytuacje kliniczne
Hipertriglicerydemia (HTG)
Wynik nieprawidłowy:
- na czczo: ≥1,7 mmol/l (≥150 mg/dl),
- nie na czczo: ≥2 mmol/l (≥175 mg/dl)
- w przypadku wyniku >10 mmol/l (>885 mg/dl) należy rozpoznać ciężką hipertriglicerydemię wiążącą się z dużym ryzykiem zapalenia trzustki; istnieje duże prawdopodobieństwo podłoża monogentycznego choroby – u dzieci i młodzieży wskazane są testy genetyczne; zalecany jest również test zimnej flotacji (sprawdzający obecność chylomikronów).
Wskazanie do farmakoterapii: >2,3 mmol/l (200 mg/dl)
Docelowe stężenia: nie ustalono, z powodu braku wystarczających dowodów naukowych, jednak niższe stężenia wskazują na mniejsze ryzyko sercowo-naczyniowe.
[Od redakcji: w nowych wytycznych PTDL /PTL 2024 za wartości nieprawidłowe uznaje się ≥100 mg/dl na czczo i ≥125 mg/dl nie na czczo. Od 500 mg/dl można rozpoznać ciężką hipertriglicerydemię, natomiast od 880 mg/dl bardzo ciężką.]
Pierwszym krokiem w postępowaniu powinno być rozpoznanie, czy HTG jest zaburzeniem pierwotnym (występującym zaledwie u kilku procent pacjentów), czy wtórnym.
| Pierwotne zespoły hipertryglicerydemii | Przyczyny wtórnej hipertryglicerydemii |
|---|---|
Monogenowa chylomikronemia | Otyłość, dieta bogata w cukry proste |
Wieloczynnikowa lub poligenowa chylomikronemia | Cukrzyca |
Dysbetalipoproteinemia | Spożycie alkoholu w nadmiernych ilościach |
Wieloczynnikowa lub poligenowa hipertriglicerydemia | Niedoczynność tarczycy |
Złożona hiperlipoproteinemia | Choroby nerek (proteinuria, mocznica,kłębuszkowe zapalenie nerek |
Paraproteinemia, toczeń układowy | |
Ciąża (szczególnie III trymestr) | |
Leki: glikokortykosteroidy, doustne estrogeny, niekardioselektywne leki β-adrenolityczne, tiazydy, retinole, leki przerywające krążenie kwasów żółciowych, inhibitory proteaz stosowane w leczeniu zakażenia HIV, tamoksifen, cyklofosfamid, cyklosporyna, L-asparaginaza, leki przeciwpsychotyczne II generacji(klozapina, olanzapina) |
Zasady postępowania farmakologicznego zebrano w tabeli poniżej.
| Łagodna do umiarkowanej –zwiększone VLDL-TG | Ciężka –obecne chylomikrony i VLDL-TG | |
|---|---|---|
Stężenie TG | 150-885 mg/dl (1,7-10 mmol/l) | >885 mg/dl (>10 mmol/l) |
Główny cel terapii | Docelowe stężenie LDL-C | Redukcja TG |
Drugorzędowy cel terapii | Docelowe stężenie nie-HDL-C | Docelowy LDL-C i nie-HDL-C,jeśli ryzyko OZT zmniejszone |
Leczenie farmakologiczne | – statyna (atorwastatyna, rozuwastatyna); – zacząć od fibratu, tylko jeśli TG >500 mg/dl (5,6 mmol/l), w celu zmniejszenia ryzyka OZ; – rozważyć dołączenie PUFA n-3, jeśli duże ryzyko sercowo-naczyniowe i TG >150 mg/dl (1,7 mmol/l); – rozważyć dołączenie fibratu, jeśli osiągnięto docelowy LDL-C, a TG >200 mg/dl (>2,3 mmol/l) w prewencji pierwotnej i u pacjentów z dużym ryzykiem. | – fibrat (fenofibrat) + PUFA n-3; – wolanesorsen w monogenowejchylomikronemii (zespół rodzinnej chylomikronemii FCS) (lek wciąż niedostępny w Polsce). |
Postępowanie z podwyższonym stężeniem Lp(a)
Optymalne stężenie: <30 mg/dl
Bardzo wysokie ryzyko incydentów sercowo-naczyniowych: >180 mg/dl.
Cząsteczka lipoproteiny (a) [Lp(a)], wykazuje działanie proaterogenne – istnieje wyraźny związek między jej stężeniem a ryzykiem choroby niedokrwiennej serca, niedokrwiennym udarem mózgu, stenozą zastawki aortalnej.
Wysokie stężenie Lp(a) może być przyczyną zawyżenia stężenia LDL-C. Warto jednak wiedzieć, że nawet 30% pacjentów z rodzinną hipercholesterolemią i/lub OZW może mieć podwyższone stężenie tej lipoproteiny przy pożądanych stężeniach LDL-C.
Wpływ leków hipolipemizujących na stężenie Lp(a) jest niejednorodny:
- w przeprowadzonych badaniach klinicznych, terapia statynami wiązała się zarówno z jego obniżeniem, jak i wzrostem (szczególnie pitawastatyna),
- największe znaczenie kliniczne przypisuje się inhibitorom PCSK9,
- obiecujące wyniki osiągane są przy zastosowaniu antysensownych oligonukleotydów przeciwko Apo(a),
- możliwe jest również przeprowadzenie aferezy Lp(a) – działanie z wyboru u osób z wysokim poziomem Lp(a) i cechami szybkiej progresji miażdżycy.
Hipercholesterolemia rodzinna
Hipercholesterolemia rodzinna (FH) to jednogenowa, dziedziczona w sposób autosomalny dominujący dyslipidemia, która charakteryzuje się wysokim stężeniem LDL-C w surowicy:
- heterozygotyczna: częstsza,
- homozygotyczna: rzadsza, LDL-C przekracza 500 mg/dl, przeważająca część chorych umiera przed ukończeniem 30. roku życia.
Rozpoznanie FH opiera się najczęściej na kryteriach DLCN (Dutch Lipid Clinic Network). Warto wiedzieć, że diagnostyka genetyczna nie jest konieczna do rozpoczęcia terapii.
Podstawą leczenia farmakologicznego są silne statyny z naciskiem na najwyższe dostępne dawki. Kolejnym krokiem jest terapia złożona z ezetymibem, a w przypadku dalszych niepowodzeń – dołączenie inhibitora PCSK9 (program lekowy B.101).
Zaburzenia gospodarki węglowodanowej
Dla cukrzycy typu 2 charakterystyczna jest aterogenna dyslipidemia. Ilościowo-jakościowe zmiany lipoprotein występują często już w stanie przedcukrzycowym. Pacjenci z dobrze kontrolowaną cukrzycą typu 1 mogą z kolei charakteryzować się tzw. “superprawidłowym” profilem lipidowym – wysokim stężeniem HDL-C oraz niskim stężeniem TG i LDL-C. Warto pamiętać, że chorzy z cukrzycą typu 1 ze współistniejącą mikroalbuminurią i przewlekłą chorobą nerek powinni być leczeni statynami niezależnie od wyjściowych wartości LDL-C. Należy dążyć u nich do obniżenia wyjściowego stężenia LDL-C przynajmniej o 50%.
Zdecydowana większość chorych na cukrzycę to osoby z bardzo wysokim lub wysokim ryzykiem sercowo-naczyniowym. Autorzy wytycznych postulują, aby za cele pierwszorzędowe terapii hipolipemizującej uznawać zarówno obniżenie stężenia LDL-C, jak i nie-HDL-C.
Potencjalne ryzyko rozwoju cukrzycy w trakcie terapii statynami nie powinno mieć wpływu na zalecenia, gdyż przeważają korzyści z ich stosowania. Warto też podkreślić całkowity brak wpływu, a nawet poprawę wskaźników metabolicznych (stężenie glukozy, HbA1c, HOMA-IR) przy leczeniu pitawastatyną.
Prawidłowa kontrola metaboliczna cukrzycy odgrywa istotną rolę w leczeniu zaburzeń lipidowych, szczególnie w przypadku hipertriglicerydemii.
Inhibitory SGLT-2 (flozyny) i agoniści receptora GLP-1 to grupy leków o udowodnionym korzystnym wpływie na ryzyko sercowo-naczyniowe. U pacjentów z przewlekłą chorobą nerek i skurczową niewydolnością serca w pierwszej kolejności preferowane są flozyny. Natomiast u chorych z ASCVD lub licznymi czynnikami ryzyka – agoniści receptora GLP-1.
Wczesne skojarzenie terapii metforminą z powyższymi grupami leków powinno być rozważane u każdego pacjenta, niezależnie od osiągnięcia celów terapeutycznych.
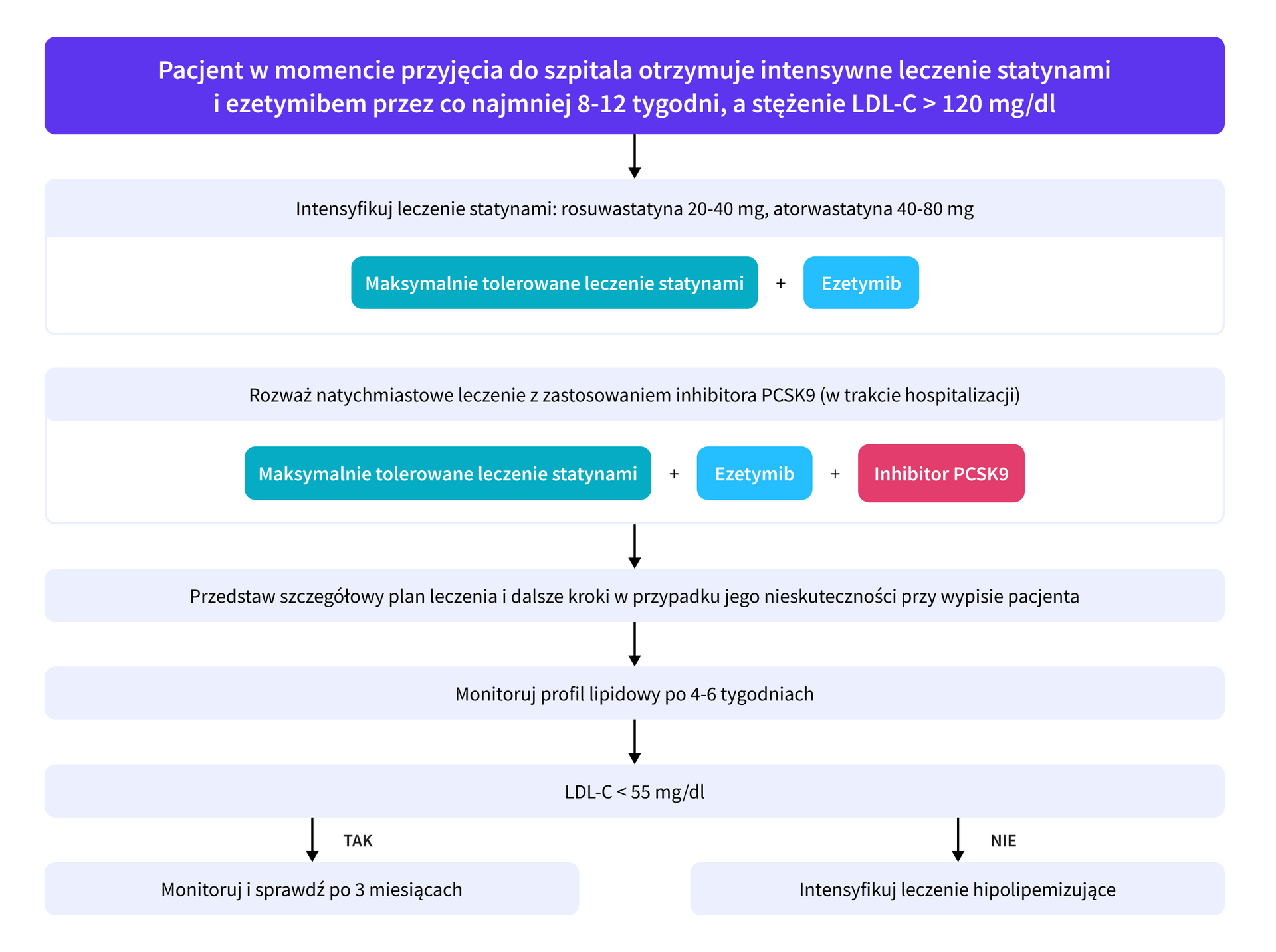
Ostre zespoły wieńcowe
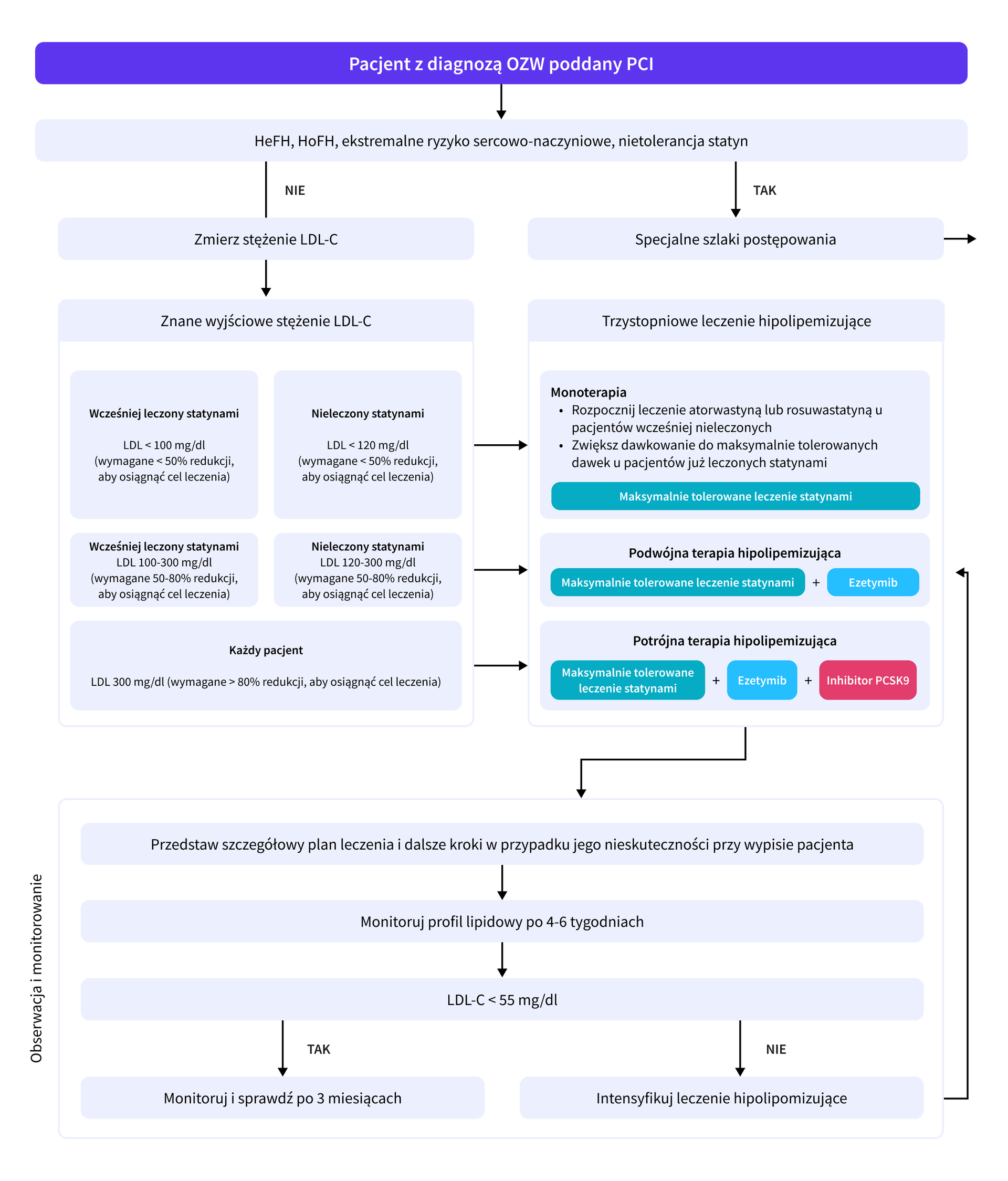
Algorytm intensywnego złożonego leczenia hipolipemizującego u pacjentów z OZW leczonych optymalnie w okresie przedszpitalnym
Przewlekła choroba nerek
U pacjentów z przewlekłą chorobą nerek zaleca się wczesne oznaczenie pełnego profilu lipidowego, który najczęściej charakteryzuje się aterogenną dyslipidemią, zazwyczaj z prawidłowym lub nieznacznie podwyższonym cholesterolem LDL oraz podwyższonymi stężeniami Lp(a).
Ocena ryzyka sercowo-naczyniowego w zależności od poziomu eGFR:
- 30-60 ml/min/1,73 m2 – duże,
- <30 ml/min/1,73 m2 – bardzo duże (I, A).
Intensywne leczenie hipolipemizujące jest zalecane u pacjentów niewymagających dializoterapii. Lekami pierwszego wyboru są statyny. U osób, które nie osiągają celu terapeutycznego, należy rozważyć leczenie skojarzone z ezetymibem (I, A) i inhibitorami PCSK9 (IIa, B). U chorych dializowanych, bez chorób sercowo-naczyniowych spowodowanych miażdżycą, leki hipolipemizujące nie powinny być włączane (III, A) lub wymaga to dużej ostrożności. Jeżeli jednak terapia statyną lub statyną z ezetymibem została włączona wcześniej, zaleca się jej kontynuację (IIa, C).
Inne jednostki chorobowe
| Jednostka chorobowa | Uwagi |
|---|---|
Optymalizując terapię chorych z nadciśnieniem tętniczym i dyslipidemią, warto pamiętać o preparatach złożonych opartych na lekach hipotensyjnych i silnej, długodziałającej statynie. [Od redakcji – na rynku polskim dostępne są połączenia dwulekowe (np. amlodypina z rozuwastatyną, walsartan z rozuwastatyną, amlodypina z atorwastatyną), oraz trójlekowe (np. perindopril, indapamid i rozuwastatyna).] | |
Stabilne zespoły wieńcowe | U chorych poddawanych zabiegom angioplastyki wieńcowej (PCI) lub pomostowaniu aortalno-wieńcowemu (CABG), należy rozważyć podanie wysycającej dawki statyny przed planowanym zabiegiem. Leczenie hipolipemizujące u każdego chorego po przezskórnej interwencji wieńcowej należy prowadzić dożywotnio – wielu chorych wymaga leczenia skojarzonego wdrożonego już w czasie hospitalizacji. |
Pacjenci, którzy przebyli udar mózgu na podłożu miażdżycowym, klasyfikowani są do grup bardzo dużego i ekstremalnego ryzyka sercowo-naczyniowego i wymagają intensywnej terapii hipolipemizującej. Nie wykazano związku przyczynowo-skutkowego między intensywnym leczeniem hipolipemizującym i bardzo niskim stężeniem cholesterolu LDL a ryzykiem wystąpienia udaru krwotocznego. Niektóre doniesienia naukowe sugerują jednak, że terapia ta w tej grupie chorych może być szkodliwa. | |
Choroba naczyń obwodowych | U pacjentów z chorobą naczyń obwodowych bardzo ważna jest niefarmakologiczna modyfikacja stylu życia – niepalenie tytoniu i regularna aktywność fizyczna, w tym trening marszowy. U pacjentów z czynnikami ryzyka oraz z chorobą sercowo-naczyniową należy zawsze pamiętać o ocenie i monitorowaniu obwodowego łożyska naczyniowego pod kątem zmian miażdżycowych (wskaźnik kostka-ramię), ultrasonografia dopplerowska). |
HIV/AIDS | Terapia antyretrowirusowa negatywnie wpływa na profil lipidowy, zwiększając prawdopodobieństwo wystąpienia dyslipidemii aterogennej. U chorych zakażonych HIV należy zwrócić szczególną uwagę na interakcje lekowe – m.in. statyn z inhibitorami proteaz ze względu na metabolizm przez CYP3A4, co prowadzi do zwiększonego ryzyka miopatii i rabdomiolizy. Statynami z wyboru w tej grupie chorych są pitawastatyna i prawastatyna. W przypadku nietolerancji statyn, należy rozważyć leczenie ezetymibem, a u niektórych chorych korzystna może być również modyfikacja leczenia antyretrowirusowego. Interakcje lekowe u pacjentów zakażonych HIV można sprawdzić na stronie www.hiv-druginteractions.org. |
Terapia hipolipemizująca przynosi korzyści pacjentom z chorobą niedokrwienną serca, u których rozwija się niewydolność, nie należy jej jednak stosować, jeżeli niewydolność serca jest jedynym wskazaniem. Preferowane, ze względu na mniejsze ryzyko występowania zdarzeń sercowo-naczyniowych, są statyny lipofilne (atorwastatyna, pitawastatyna, simwastatyna). | |
Choroby wątroby | Leczenie statynami jest przeciwwskazane jedynie w przypadku ostrej, aktywnej choroby wątroby. Duże korzyści z leczenia hipolipemizującego mogą odnieść chorzy z przewlekłym WZW, pierwotną marskością żółciową wątroby, niealkoholową stłuszczenią chorobą wątroby (NAFLD), niealkoholowym stłuszczeniowym zapaleniem wątroby (NASH) i innymi. Leczenie należy prowadzić w konsultacji z lekarzem hepatologiem lub gastroenterologiem. W przypadku chorych z NAFL i NASH, u których wyjściowe ALT przekracza 3 x ggn, można rozważyć włączenie statyny w niskich dawkach, z koniecznością monitorowania ALT co miesiąc przez3 miesiące, a następnie 4 razy w roku. |
COVID-19 | U chorych z COVID-19 należy jak najszybciej optymalizować leczenie hipolipemizujące, szczególnie u osób wysokiego lub bardzo wysokiego ryzyka sercowo-naczyniowego, u których należy zastosować najwyższe rekomendowane dawki statyn (IIa, C). Inicjacja lub intensyfikacja terapii oraz jej monitorowanie możliwe jest także podczas telewizyty/teleporady (I, C). |
Schorzenia terminalne, stany paliatywne | Decyzja dotycząca włączenia leczenia hipolipemizującego w przypadku schorzeń terminalnych i stanów paliatywnych powinna być podejmowana w oparciu o ocenę korzyści i możliwego ryzyka związanego z terapią, ponieważ według doniesień naukowych, leczenie to może pogarszać jakość życia w tej grupie chorych. |
Dzieci i młodzież
Celem leczenia dyslipidemii u dzieci i młodzieży jest uzyskanie stężenia LDL-C <130 mg/dl (<3,4 mmol/l, <95. percentyla) lub jego obniżenie o 30–50%.
U dzieci z cukrzycą oraz FH i wywiadem rodzinnym wskazującym na chorobę wieńcową przed 40. rokiem życia zalecane jest uzyskanie stężenia LDL-C <100 mg/dl (<2,6 mmol/l) lub redukcja o co najmniej 50%.
Podstawą postępowania niefarmakologicznego jest gruntowna edukacja zdrowotna dotycząca całej rodziny. Modyfikację stylu życia, w tym prawidłowe odżywianie, zwiększenie aktywności fizycznej, zapobieganie paleniu czynnemu i biernemu oraz spożywaniu alkoholu, należy wprowadzić u każdego dziecka powyżej 2. roku życia, u którego stwierdza się:
- stężenie LDL-C >100 mg/dl (>2,6 mmol/l),
- podwyższone stężenie TG – dzieci <10 lat z TG ≥100 mg/dl (≥1,1 mmol/l), dzieci 10-19 lat z TG ≥130 mg/dl (≥1,5 mmol/l).
Farmakoterapię należy natomiast rozpocząć u dzieci i młodzieży ≥10. roku życia (w przypadku FH ≥8. r.ż) zgodnie z poniższą tabelą:
| Charakterystyka pacjenta | Parametr lipidowy i stężenie |
|---|---|
Bez czynników ryzyka sercowo-naczyniowego | LDL-C ≥190 mg/dl (≥4,9 mmol/l) |
Z jednym czynnikiem wysokiego ryzyka (nadciśnienie tętnicze wymagające farmakoterapii, niewydolność nerek, BMI >97. percentyla) i dwoma czynnikami pośredniego ryzyka (nadciśnienie tętnicze bez farmakoterapii, HDL <1,0 mmol/l (<40 mg/dl), BMI 95.–97. percentyl, przewlekła choroba zapalna, zespół nefrotyczny), z wywiademrodzinnym wczesnej choroby sercowo-naczyniowej (przed 55. rokiem życia) | LDL-C ≥160 mg/dl (≥4,2 mmol/l) |
Z cukrzycą lub z FH | LDL-C ≥130 mg/dl (≥3,4 mmol/l) |
Bez lub z czynnikami ryzyka | TG ≥200 mg/dl (≥2,2 mmol/l) |
Przed leczeniem należy oznaczyć aktywność aminotransferaz oraz kinazy kreatynowej. Stosowane w terapii leki to m.in.:
- atorwastatyna 5-40 mg,
- rozuwastatyna 5-20 mg,
- ezetymib 10 mg.
Warto pamiętać, że w przypadku pierwotnej prewencji sercowo-naczyniowej rozpoczęcie farmakoterapii wskazane jest po 6 miesiącach, jeśli zmiany stylu życia nie są wystarczające (I, A).
W przypadku hipertriglicerydemii, farmakoterapia jest na ogół zarezerwowana dla pacjentów z wysokim stężeniem TG (>500 mg/dl – ryzyko ostrego zapalenia trzustki, potrzeba pilnego obniżenia) i chorobami genetycznymi.
Osoby w wieku podeszłym
Optymalizując terapię u chorych w wieku podeszłym, należy wziąć pod uwagę dodatkowe czynniki, takie jak wielochorobowość, polifarmakoterapia czy zmiany w farmakokinetyce leków. Zwiększa się m.in. ryzyko nietolerancji statyn. W związku z tym autorzy wytycznych rekomendują, aby:
- leczenie statynami rozpoczynać od małych dawek,
- wybierać preparaty hydrofilne (rozuwastatyna, prawastatyna),
- rozważyć czasowe odstawienie statyn u pacjentów w wieku podeszłym w sytuacjach, w których wzrasta ryzyko ich nietolerancji.
Warto również dodać, że według wytycznych (2019) ESC/EAS:
- leczenie statynami jest zalecane w profilaktyce pierwotnej u osób w wieku ≤75 lat w zależności od poziomu ryzyka sercowo-naczyniowego (I, A),
- leczenie statynami w prewencji pierwotnej >75 lat można rozważyć u osób należących do grupy wysokiego lub bardzo wysokiego ryzyka (IIb, B).
Ciąża i okres karmienia
W przebiegu ciąży obserwowany jest fizjologiczny wzrost:
- TG – w II i szczególnie III trymestrze – 2,5 krotny,
- LDL-C – max. 50%,
- Lp(a) – 30-40%.
Statyny zaliczane są do kategorii X – leczenie należy przerwać na co najmniej 3 miesiące przed planowanym zajściem w ciążę, w okresie ciąży i laktacji!
Należy jednak dodać, że ryzyko uszkodzenia płodu nie jest duże, a coraz liczniejsze doniesienia mówią o braku ryzyka stosowania statyn.
Jedynymi bezpiecznymi lekami hipolipemizującymi w ciąży są żywice jonowymienne.
Od redakcji – przydatne materiały
Zachęcamy do korzystania z materiałów i narzędzi dostępnych na naszej stronie i w aplikacji, które przydadzą się w codziennej praktyce klinicznej:
- Poradniki – praktyczne opracowanie informacji dotyczących m.in. prowadzenia wywiadu i badania przedmiotowego, procesu diagnostycznego, leczenia, a także najważniejszych programów lekowych:
- Webinary:
- Aktualne możliwości leczenia hipercholesterolemii w Polsce – omówienie najważniejszych kwestii związanych z programem lekowym B.101;
- Pacjent bardzo wysokiego ryzyka sercowo-naczyniowego. Omówienie algorytmów postępowania z pacjentem z hipercholesterolemią w gabinecie lekarza POZ. – praktyczne omówienie wytycznych Polskiego Towarzystwa Kardiologicznego i Polskiego Towarzystwa Lipidologicznego.
- Kalkulatory medyczne:
- skala POL-SCORE 2015;
- wskaźnik SCORE2 i SCORE2-OP;
- wskaźnik SCORE2-diabetes;
- skala DLCN – prawdopodobieństwo hipercholesterolemii rodzinnej;
- przelicznik jednostek cholesterolu i triglicerydów.
- Wyszukiwarka leków – narzędzie, które pozwala sprawdzić dawkowanie, refundacje, interakcje i inne ważne dane dotyczące leków.
- Baza kodów ICD-10 – pomaga zakodować konkretną jednostkę chorobową w klasyfikacji ICD:




