Wyszukaj w publikacjach
Biochirurgia w gojeniu ran przewlekłych – czy larwy mogą działać lepiej niż skalpel?

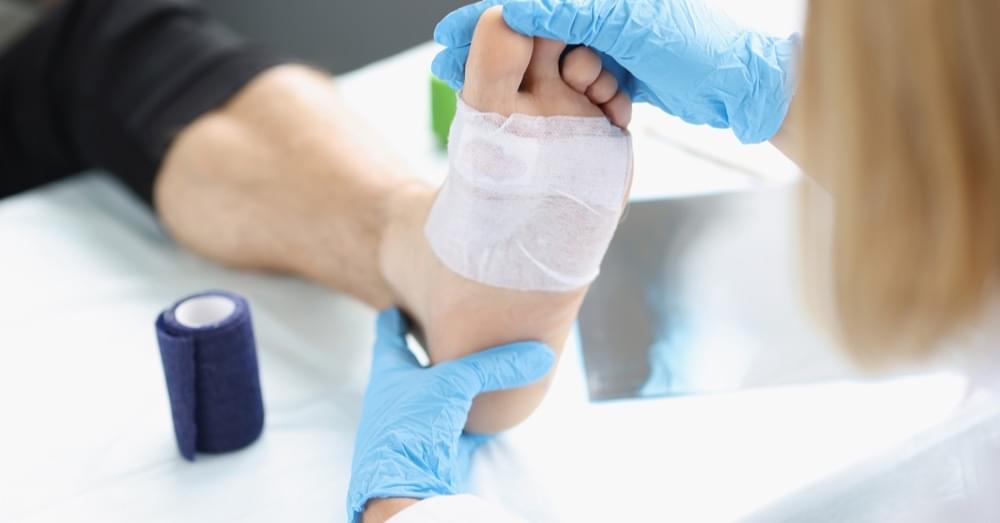
Terapia larwalna ran (TLR) to metoda, która wykorzystuje sterylne larwy muchy Lucilia sericata, które w sposób selektywny oczyszczają łożysko rany z tkanek martwiczych, jednocześnie wpływając na mikrośrodowisko rany i przyczyniając się do przyspieszenia gojenia. Wydzieliny larw zawierają m.in. enzymy proteolityczne, które rozkładają martwicę. Wykazują także działanie przeciwbakteryjne i antybiofilmowe oraz mogą stymulować procesy ziarninowania i naskórkowania. Metoda ta, choć znana od wieków, ponownie zyskuje zainteresowanie kliniczne w dobie narastającej oporności bakterii i poszukiwania skutecznych, selektywnych technik oczyszczania ran [1,2].
Rola biochirurgii w praktyce – oczyszczenie rany
Usunięcie tkanek martwiczych to kluczowy etap przygotowania łożyska rany do gojenia: zmniejsza obciążenie bakteryjne i skraca fazę zapalną leczenia ran. Wśród metod oczyszczania ran wyróżnia się oczyszczanie mechaniczne, chirurgiczne, autolityczne, enzymatyczne i biochirurgiczne. Terapia larwalna znajduje zastosowanie w przypadkach, gdy zabieg chirurgiczny jest ryzykowny, a tradycyjne metody zbyt powolne [1,2].
Wskazania kliniczne do terapii larwalnej ran
Terapia larwalna jest zalecana w leczeniu trudno gojących się ran przewlekłych, o ustalonej etiologii, szczególnie gdy inne metody są nieskuteczne lub przeciwwskazane:
- rany w przebiegu cukrzycowej choroby stóp o etiologii neuropatycznej, mieszanej i niedokrwiennej (po leczeniu rewaskularyzacyjnym);
- owrzodzenia goleni o etiologii żylnej, mieszanej i tętniczej (po leczeniu rewaskularyzacyjnym);
- odleżyn.
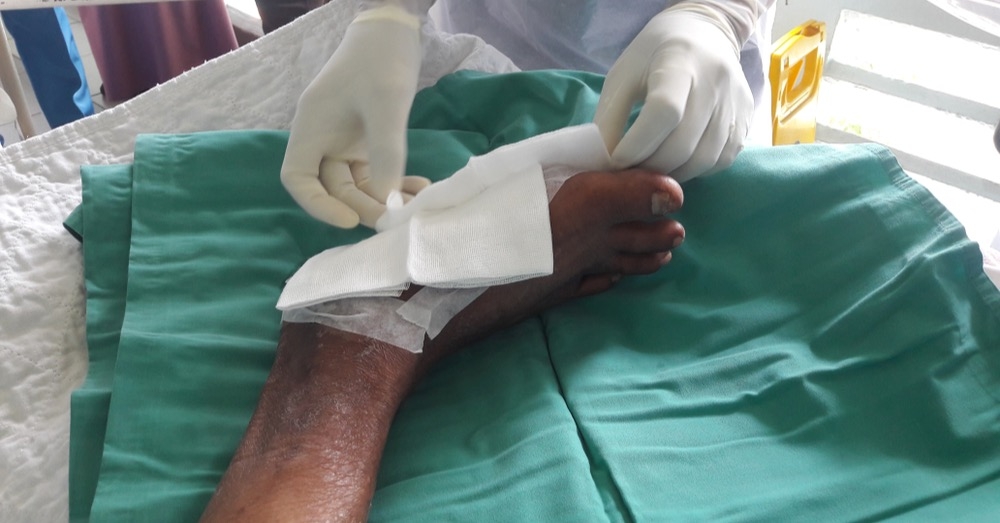
Zastosowanie TLR rozważa się po optymalizacji leczenia przyczynowego (np. rewaskularyzacja w niedokrwieniu, kompresjoterapia w owrzodzeniach żylnych, odciążenie w stopie cukrzycowej). W tych przypadkach biochirurgia umożliwia szybkie i selektywne oczyszczenie rany, zmniejszenie zapachu i ilości wydzieliny oraz przygotowanie rany do dalszych etapów leczenia, takich jak terapia podciśnieniowa (negative pressure wound therapy, NPWT) czy autoprzeszczepienie skóry [1,2,3].
Zasady stosowania i bezpieczeństwo terapii larwalnej
Stosuje się larwy wolne lub zamknięte w opatrunkach typu biobag. Rany przed aplikacją należy wypłukać i zabezpieczyć skórę wokół. Zabieg trwa zwykle 48–72 godziny, po czym larwy usuwa się i ewentualnie powtarza procedurę. Zabieg wymaga odpowiedniego przeszkolenia personelu oraz współpracy pacjenta [1,3].
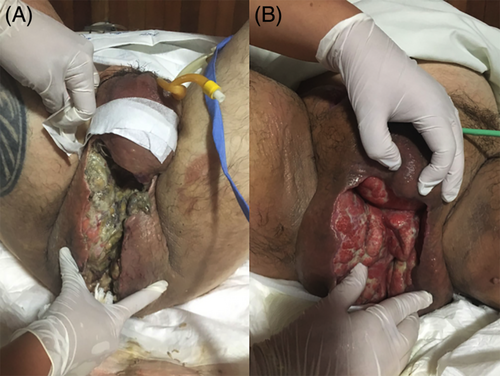

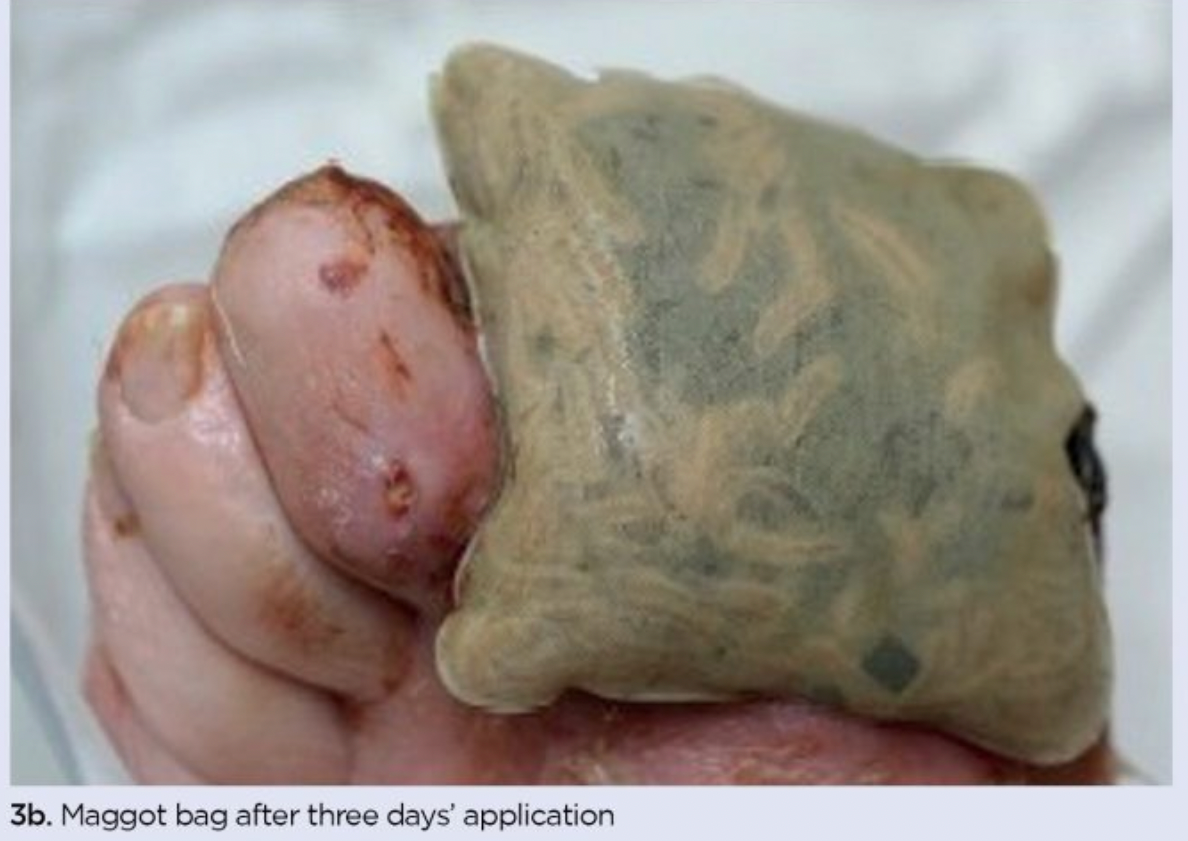
Terapia jest zwykle dobrze tolerowana przez pacjentów. Najczęstsze działania niepożądane to:
- podrażnienie i maceracja otaczającej skóry,
- zaczerwienienie skóry,
- obrzęk okolicy rany,
- ból,
- świąd.
Przeciwwskazania obejmują m.in.:
- niedokrwistość,
- gorączkę,
- obecność suchej martwicy w ranie,
- czynne krwawienie w obrębie rany,
- nowotwory w obrębie rany,
- niedokrwienie bez rewaskularyzacji,
- podejrzenie lub stwierdzenie etiologii autoimmunologicznej lub autozapalnej rany,
- bezpośrednią bliskość dużych naczyń krwionośnych,
- potencjalną komunikację rany z jamą ciała,
- brak możliwości odciążenia rany,
- brak zgody pacjenta,
- ciążę [2,3].
Dowody naukowe na skuteczność i bezpieczeństwo wykorzystania larw w leczeniu ran
Metaanaliza z 2025 roku [1] wykazała, że larwoterapia może być skuteczniejsza niż standardowe metody w uzyskaniu pełnego oczyszczenia rany, jednak wynik nie osiągnął granicy istotności statystycznej, a heterogeniczność badań była wysoka – co wymaga ostrożnej interpretacji w praktyce klinicznej. Wydzieliny larw wykazują działanie przeciwbakteryjne i antybiofilmowe. Kliniczne znaczenie tych efektów jest obiecujące. Konieczne są dalsze, dobrze zaprojektowane badania.
Podsumowanie
Choć koszt jednostkowy aplikacji larw jest zwykle wyższy niż koszt standardowego opatrunku, dane sugerują, że metoda ta może – w wybranych sytuacjach – zmniejszyć liczbę hospitalizacji i skrócić czas leczenia. Aby zachować najwyższe standardy bezpieczeństwa i skuteczności, konieczne jest przeszkolenie personelu oraz dostępność sterylnych larw, a także monitorowanie bólu i stanu skóry wokół rany w trakcie terapii [3].
Źródła
- Lam, T., Beraja, G. E., & Lev-Tov, H. (2025). Efficacy of Larval Therapy for Wounds: A Systematic Review and Meta-Analysis. Journal of clinical medicine, 14(2), 315. https://doi.org/10.3390/jcm14020315
- Strohal, R., Dissemond, J., Jordan O'Brien, J., Piaggesi, A., Rimdeika, R., Young, T., & Apelqvist, J. (2013). EWMA document: Debridement. An updated overview and clarification of the principle role of debridement. Journal of wound care, 22(1), 5. https://doi.org/10.12968/jowc.2013.22.Sup1.S1
- Mrozikiewicz-Rakowska, B., Tusiński, M., Lipiński, P., Bazaliński, D., Dynarska, J., Czwakiel, L., Zymon, A., Mospan, B., Malinowska, K., Sopata, M., & Jawień, A. (2023). Stanowisko Polskiego Towarzystwa Leczenia Ran na temat terapii larwalnej ran. Leczenie Ran, 20(3), A89–A95. https://doi.org/10.60075/lr.v20i3.43