Wyszukaj w poradnikach
Migotanie przedsionków
Krótka teoria
Migotanie przedsionków (ang. atrial fibrillation, AF) to najczęstsza tachyarytmia nadkomorowa, którą cechuje szybka (350-700/min), nieskoordynowana aktywacja przedsionków, prowadząca do utraty efektywności hemodynamicznej ich skurczu z towarzyszącym niemiarowym rytmem komór.
W podczas definiowania AF wyróżnia się także kliniczne AF – objawowe lub bezobjawowe, które zostało udokumentowane za pomocą EKG, jak również subkliniczne AF, obejmującym AHRE (ang. atrial high rate episodes). AHRE to epizody szybkiego rytmu przedsionkowego, wykrywane przez niektóre urządzenia wszczepialne, które wymagają oceny wzrokowej, ponieważ część z nich to artefakty, a nie zapisy arytmii. Pacjenci z AHRE wymagają regularnej kontroli progresji zaburzeń rytmu do AF oraz powtarzanej oceny ryzyka zakrzepowo zatorowego według CHA2DS2-VA.
Wywiad
- Czy pacjent/pacjentka zgłasza dolegliwości, takie jak: kołatanie serca, pocenie się, osłabienie i upośledzenie tolerancji wysiłku, omdlenia, zawroty głowy, duszność, ból w klatce piersiowej? – jest to typowa prezentacja migotania przedsionków, często podczas trwania napadu. Niektórzy pacjenci skarżą się takżę na uczuccie niepokoju, zaburzenia snu czy zaburzenia nastroju. Warto jednak pamiętać, że arytmia, choć w rzadszych przypadkach, może też przebiegać bezobjawowo i być wykryta przypadkowo podczas analizy EKG. Bezobjawowe migotanie przedsionków jest związane z takim samym ryzykiem incydentów zakrzepowo-zatorowych jak objawowa arytmia!
- Czy pacjent/pacjentka cierpi na któreś z zaburzeń wymienionych poniżej? – stanowią one czynniki ryzyka lub choroby współistniejące z migotaniem przedsionków;
| Sercowe przyczyny i choroby współistniejące z AF | Przyczyny pozasercowe AF |
|---|---|
wady zastawkowe nabyte (głównie zastawki mitralnej) | ostre zakażenie |
choroba niedokrwienna serca (głównie jako powikłanie po zawale serca) | znieczulenie ogólne |
niewydolność serca, niezależnie od przyczyny | choroby płuc |
kardiomiopatie (w szczególności rozstrzeniowa i przerostowa) | obturacyjny bezdech senny |
wady wrodzone serca (głównie z przeciekiem międzyprzedsionkowym) | guz chromochłonny |
zapalenie mięśnia sercowego i osierdzia | |
przebyte operacje serca | |
dysfunkcje węzła zatokowego – zespół tachykardia-bradykardia | |
zespół preekscytacji | |
choroby układowe z zajęciem serca, np. sarkoidoza | uprawianie sportu – dyscypliny wytrzymałościowe |
nowotwory serca – pierwotne i przerzutowe | substancje – alkohol, tlenek węgla, kofeina, niektóre leki |
(na podstawie Interna Szczeklika 2024. Podręcznik chorób wewnętrznych. Medycyna Praktyczna. Wydanie 15. 2024)
- Czy pacjent/pacjentka przebył kiedyś udar niedokrwienny? – udar mózgu jest najgroźniejszym powikłaniem AF – nieefektywna hemodynamicznie praca przedsionków prowadzi do powstawania skrzepliny, która może przedostać się do naczyń dogłowowych i spowodować udar niedokrwienny. Inne epizody zakrzepowo-zatorowe, takie jak zatory w krążeniu systemowym lub choroba niedokrwienna serca są również częstym powikłaniem u pacjentów z AF.
- Czy w rodzinie pacjenta/pacjentki występowały wymienione wyżej choroby, AF lub udar niedokrwienny? – istnieje AF uwarunkowane genetycznie. Obciążenie rodzinne również zwiększa ryzyko zachorowania na choroby układu sercowo-krążeniowego, będące istotnym czynnikiem ryzyka AF.
- W jakim wieku jest pacjent/pacjentka? – częstość występowania AF rośnie wraz z wiekiem; wiek podeszły sprzyja występowaniu chorób współistniejących, będących czynnikiem ryzyka AF.
Ocena kliniczna pacjenta
Obowiązuje pełne badanie internistyczne, ukierunkowane pod kątem danych z wywiadu.
- Oceń podstawowe parametry życiowe pacjenta: HR, BP, częstość oddechów, saturację, powrót włośniczkowy, określ BMI.
- Oceń tętno – ubytek tętna na obwodzie i niemiarowe tętno to cechy charakterystyczne AF:
- u pacjentów >65. r.ż. zaleca się przesiewowe badanie tętna oraz wykonywanie 12-odprowadzeniowego EKG jako element strategii wczesnego wykrywania arytmii;
- u pacjentów >75. r.ż. lub obciążonych wysokim ryzykiem udaru niedokrwiennego warto rozważyć systematyczne badania przesiewowe, z kolei u pacjentów po TIA lub udarze należy rozważyć badanie holter-EKG.
- Osłuchaj serce – szmery mogą świadczyć o wadach zastawkowych, które są częstymi patologiami w przebiegu migotania przedsionków; oceń miarowość akcji serca – niemiarowość jest charakterystyczna dla AF.
- Wykonaj 12-odprowadzeniowe EKG. Cechy charakterystyczne dla AF to:
- niemiarowość zupełna – nieregularne odstępy między zespołami QRS;
- brak załamka P, który jest zastąpiony falą f (najlepiej widoczną w odprowadzeniach V1, V2);
- AF możesz rozpoznać również po ocenie zapisu z jednego odprowadzenia, które nie budzi twoich wątpliwości i trwa minimum 30 s – takie zapisy prezentują np. niektóre smartwatche czy aplikacje na smartfonie;
- zapis EKG różnicuj z innymi arytmiami – więcej informacji na ten temat znajdziesz tutaj.
- Jeżeli potwierdzasz AF w EKG, zastosuj schemat 4S-AF:
- oceń ryzyko udaru mózgu (stroke risk) za pomocą skali CHA2DS2-VA,
- oceń nasilenie objawów (symptom severity) za pomocą skali EHRA:
| Klasa | Opis |
|---|---|
1 | bez objawów podmiotowych |
2a | objawy łagodne – nie zakłócają normalnej, codziennej aktywności |
2b | objawy umiarkowane – dokuczliwe dla chorego, ale nie zakłócają normalnej, codziennej aktywności |
3 | objawy ciężkie – normalna, codzienna aktywność jest ograniczona |
4 | objawy uniemożliwiające funkcjonowanie – normalna, codzienna aktywność jest niemożliwa |
(na podstawie Interna Szczeklika 2024. Podręcznik chorób wewnętrznych. Medycyna Praktyczna. Wydanie 15. 2024)
- oceń częstość występowania AF – jaka jest postać AF; ładunek – całkowity czas AF w okresie monitorowania, najdłuższe epizody, liczba epizodów, tendencja do samoustępowania;
- oceń nasilenie podłoża arytmii (substrate severity) – jakie są choroby współistniejące, jaki jest stopień ich wyrównania.
UWAGA! CZERWONA FLAGA!
- Jeżeli w EKG stwierdzasz migotanie przedsionków, a pacjent/pacjentka prezentuje cechy niestabilności hemodynamicznej, takie jak omdlenie, objawy niewydolności serca, niedokrwienie mięśnia sercowego, objawowe niedociśnienie lub objawy wstrząsu kardiogennego:
- jak najszybciej wezwij zespół ratownictwa medycznego – pacjent wymaga pilnej kardiowersji elektrycznej;
- monitoruj podstawowe parametry życiowe – pomiar saturacji, tętna, ciśnienia tętniczego;
- monitoruj EKG, jeśli masz taką możliwość;
- zapewnij co najmniej 2 dostępy dożylne (najlepiej min. 18G, “zielony wenflon”).
Postępowanie diagnostyczne
Podstawą dla rozpoznania AF jest wykonanie 12-odprowadzeniowego EKG. Ponadto warto wykonać również:
| Badania dostępne w POZ | Opieka koordynowana w ścieżce kardiologicznej | Badania dostępne w AOS |
|---|---|---|
badania laboratoryjne – celem poszukiwania przyczyny AF oraz oceny stanu ogólnego pacjenta, przede wszystkim: morfologia krwi obwodowej, stężenie kreatyniny z oceną eGFR, badanie ogólne moczu, stężenie TSH, fT3 i fT4, stężenie HbA1C, stężenie elektrolitów (Na, K) | badania laboratoryjne – analogiczne do tych dostępnych w POZ; warto oznaczyć również stężenie NT-proBNP* i troponinę celem oceny funkcji mięśnia sercowego i poszerzenia diagnostyki niewydolności serca | badania laboratoryjne – analogiczne do tych dostępnych w POZ; warto oznaczyć również stężenie NT-proBNP* i troponinę celem oceny funkcji mięśnia sercowego i poszerzenia diagnostyki niewydolności serca |
RTG klatki piersiowej – może wykazać nieprawidłowości wskazujące na przyczynę AF, np. zastój w krążeniu płucnym, powiększenie sylwetki serca | angio-TK tętnic wieńcowych – jako alternatywna metoda diagnostyczna przy podejrzeniu choroby niedokrwiennej serca | TK, angiografia, MRI – wykonywane w celu wykluczenia choroby niedokrwiennej serca oraz w trakcie kwalifikacji do zabiegu ablacji przezcewnikowej |
przezklatkowa echokardiografia* – umożliwia wykrycie przyczyny AF, jeśli jest nią strukturalna wada serca; aktualnie niezbędna u wszystkich pacjentów z AF ze względu na dobór optymalnego leczenia farmakologicznego | przezklatkowa echokardiografia* – umożliwia wykrycie przyczyny AF, jeśli jest nią strukturalna wada serca; aktualnie niezbędna u wszystkich pacjentów z AF, ze względu na dobór optymalnego leczenia farmakologicznego | |
Holter EKG – przedłużone monitorowanie (24, 48, 72 godziny) zwiększa szansę rozpoznania dotychczas niezdiagnozowanego AF | Holter EKG – przedłużone monitorowanie zwiększa szansę rozpoznania dotychczas niezdiagnozowanego AF obrazowanie OUN i ewaluacja funkcji poznawczych w celu oceny nasilenia zmian naczyniopochodnych oraz ryzyka demencji | |
Holter RR – w celu poszerzenia diagnostyki nadciśnienia tętniczego |
Pacjentów z AHRE systematycznie monitoruj, aby wykryć progresję do klinicznego AF.
Zalecenia
Leczenie chorego z AF należy prowadzić zgodnie z algorytmem AF-CARE:
- C (comorbidity and risk factors management) – kontrola chorób współistniejących oraz czynników ryzyka;
- A (avoid stroke and thromboembolism) – wdrożenie leczenia przeciwkrzepliwego;
- R (reduce symptoms by rate and rhythm control) – odpowiednia kontrola rytmu serca i częstości akcji serca;
- E (evaluation and dynamic reassessment) – ocena efektów leczenia i monitorowanie stanu pacjenta
Optymalizacja chorób współistniejących
Niewłaściwa kontrola chorób współistniejących, takich jak nadciśnienie tętnicze, niewydolność serca, cukrzyca, otyłość czy obturacyjny bezdech senny u pacjentów z migotaniem przedsionków jest związana z częstszymi napadami arytmii i progresją AF. Konieczne są także zmiany dotyczące trybu życia pacjentów, jakie jak ograniczenie spożywania alkoholu oraz zwiększenie aktywności fizycznej.
| Choroba współistniejąca | Cele lecznicze u pacjentów z AF |
|---|---|
U większości dorosłych pacjentów zaleca się utrzymywanie ciśnienia skurczowego w granicach 129-120 mmHg, a rozkurczowego w granicach 79-70 mmHg lub tak niskiego, jakie jest dobrze tolerowane przez pacjenta | |
Zaleca się terapię diuretykami w razie zastoinowej niewydolności serca, optymalizację leczenia niewydolności serca ze zmniejszoną frakcją wyrzutową. Inhibitory SGLT2 są zalecane zarówno przy obniżonej, jak i zachowanej frakcji wyrzutowej lewej komory | |
Efektywna kontrola glikemii przy użyciu farmakoterapii lub diety | |
Zmniejszenie masy ciała o 10% u pacjentów z nadwagą lub otyłością. U wybranych pacjentów z BMI ≥40, rozważenie kwalifikacji do operacji bariatrycznej | |
Obturacyjny bezdech senny | Rozważenie przeprowadzenia diagnostyki w kierunku OBS (polisomnografia) i zminimalizowanie nocnych bezdechów - rozważenie CPAP |
Ryzyko zakrzepowo-zatorowego vs ryzyko krwawienia
Ocenę ryzyka powikłań zakrzepowo-zatorowych określ, używając skali CHA2DS2-VA:
| Czynnik ryzyka | Opis | Punktacja |
|---|---|---|
C | Niewydolność serca (z zachowaną, łagodnie obniżoną lub obniżoną frakcją), również asymptomatyczna LVEF ≤40% | 1 |
H | Nadciśnienie tętnicze (BP ≥140/90 mmHg w dwóch pomiarach lub leczenie hipotensyjne) | 1 |
A | wiek ≥75 lat | 2 |
D | Cukrzyca typu 1 lub 2 albo leczenie hipoglikemizujące | 1 |
S | Udar niedokrwienny, TIA lub inny incydent naczyniowy w wywiadzie | 2 |
V | Choroba naczyniowa (choroba wieńcowa, choroba naczyń obwodowych, potwierdzona w badaniu obrazowym miażdżyca aorty | 1 |
A | Wiek 65-74 lat | 1 |
Należy podkreślić, że w nowej wersji wytycznych skala CHA2DS2-VA nie odnosi ryzyka do płci pacjenta!
Osiągnięcie wyniku 2 punktów w skali CHA2DS2-VA jest wskazaniem do rozpoczęcia leczenia przeciwkrzepliwego, w związku ze znacznym ryzykiem zakrzepowo-zatorowym. Ponadto, wdrożenie leczenia należy rozważyć także u pacjentów z tylko 1 punktem w skali CHA2DS2-VA.
Stratyfikacja ryzyka krwawienia jest konieczna ze względu na optymalizację bezpieczeństwa terapii przeciwkrzepliwej, jednak skale oceniające ryzyko krwawienia, takie jak skala HAS-BLED, nie powinny być używane przy decyzji o rozpoczęciu leczenia przeciwkrzepliwego.
W praktyce należy przede wszystkim dążyć do eliminacji modyfikowalnych czynników ryzyka krwawienia, do których zalicza się m.in.:
- nadciśnienie tętnicze,
- przyjmowanie leków predysponujących do krwawienia (m.in. przeciwpłytkowe, NLPZ),
- nadmierne spożycie alkoholu (8 drinków/tydz.),
- źle dobrany lek przeciwkrzepliwy,
- niezadowalający compliance.
Celem redukcji ryzyka krwawień można rozważyć dołączenie do leczenia inhibitorów pompy protonowej, zwłaszcza u pacjentów z krwawieniami z przewodu pokarmowego, chorobą wrzodową w wywiadzie oraz u tych, którzy wymagają równoczesnego stosowania leków przeciwpłytkowych.
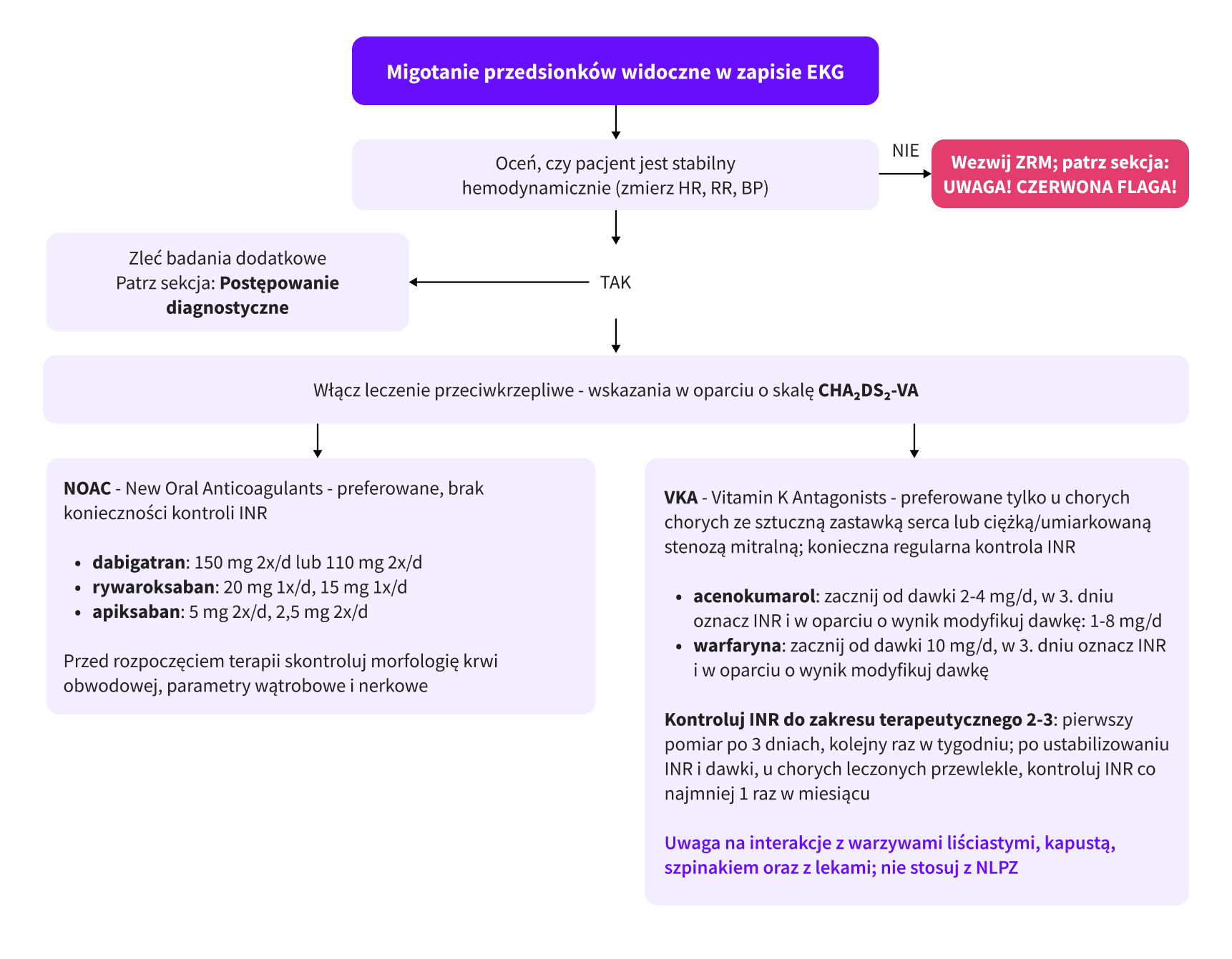
Leczenie przeciwkrzepliwe
Obecnie preferowaną grupą leków przeciwkrzepliwych u pacjentów z AF są NOAC (New Oral Anticoagulants). Przed rozpoczęciem leczenia należy oznaczyć parametry funkcji nerek (eGFR ocenić z wykorzystaniem wzoru Cockrofta-Gaulta; czynność nerek ma wpływ na dawkowanie) oraz wątroby, a także wykonać morfologię krwi obwodowej. Obecnie dostępne są 4 leki z grupy NOAC:
- dabigatran,
- apiksaban,
- rywaroksaban, np. w postaci preparatu Rixacam,
- edoksaban.
| Lek – dawka | Kryteria redukcji dawki |
|---|---|
Dabigatran – 150 mg 2x/d | Zredukuj do dawki 110 mg 2x/d u pacjentów spełniających którekolwiek z poniższych kryteriów: 80 lat, jednocześnie stosujących werapamil. Zindywidualizowane rozważenie redukcji dawki u pacjentów w wieku 75-80 lat, z eGFR 30-50 ml/min, chorujących na zapalenie żołądka, przełyku lub GERD oraz ze zwiększonym ryzykiem krwawienia |
Rywaroksaban – 20 mg 1x/d | Zredukuj do dawki 15 mg 1x/d u pacjentów z eGFR 15-50 ml/min |
Apiksaban – 5 mg 2x/d | Zredukuj do dawki 2,5 mg 2x/d u pacjentów spełniających co najmniej 2 z 3 kryteriów: wiek 80 lat, masa ciała 60 kg, stężenie kreatyniny w surowicy 1,5 mg/dl |
Edoksaban – 60 mg 1x/d | Zredukuj do dawki 30 mg 1x/d u pacjentów z eGFR 15-50 ml/min, o masie ciała ≤60 kg lub przy jednoczesnym stosowaniu ketokonazolu, cyklosporyny, erytromycyny albo dronedaronu |
VKA (Vitamin K Antagonists): warfaryna, acenokumarol – powinny być stosowane przede wszystkim u chorych ze sztuczną zastawką serca lub ciężkim/umiarkowanym zwężeniem zastawki mitralnej – u tych chorych nie należy stosować NOAC. U chorych leczonych VKA konieczne jest monitorowanie stężenia INR, tak by oscylował on w przedziale terapeutycznym (INR=2-3).
Ponadto pacjenci kwalifikowani do operacji kardiochirurgicznych mogą dodatkowo zostać poddani zamknięciu uszka lewego przedsionka celem dodatkowego zabezpieczenia przed incydentami zakrzepowo-zatorowymi.
Kontrola rytmu serca i częstości akcji serca – farmakoterapia
Kontrola akcji serca lub utrzymanie rytmu zatokowego pozwala zminimalizować objawy migotania przedsionków oraz pozytywnie wpływa na rokowanie pacjentów. W postępowaniu z pacjentem z AF można zastosować strategię utrzymywania zalecanej częstości pracy komór serca lub dążyć do uzyskania rytmu zatokowego.
Lekami z wyboru stosowanymi w celu kontroli częstości akcji serca są preparaty z grupy β-blokerów, diltiazem, werapamil lub digoksyna. U pacjentów z LVEF<40% zalecane są β-blokery i digoksyna. Początkowym celem terapeutycznym powinno być uzyskanie akcji komór <110 uderzeń/min.
Jest to terapia pierwszego rzutu w razie ostrego lub świeżo rozpoznanego, objawowego AF, jako dodatkowa terapia do strategii utrzymywania rytmu zatokowego lub jako jedyne leczenie utrwalonego AF w celu redukcji objawów.
| Lek | Dawka p.o. | Przeciwwskazania |
|---|---|---|
β-blokery | ||
25-100 mg 2x/d | Nieselektywne β-blokery są względnie przeciwwskazane w astmie oskrzelowej. Nie włączać w zaostrzeniu niewydolności serca oraz u pacjentów z ciężkim skurczem oskrzeli w wywiadzie | |
50-200 mg 1x/d | ||
1,25-20 mg 1x/d | ||
25-100 mg 1x/d | ||
2,5-10 mg 1x/d | ||
3,125-50 mg 2x/d | ||
antagoniści wapnia | ||
40 mg 2x/d lub 480 mg (preparat typu retard) 1x/d | Przeciwwskazane, gdy LVEF ≤40%.Konieczność dostosowania dawki u pacjentów z PChN i zaburzeniami funkcji wątroby | |
60 mg 3x/d lub 360 mg (preparat typu retard) 1x/d | ||
glikozydy | ||
0,0625-0,25 mg 1x/d | Konieczne dostosowanie dawki do funkcji nerek. Wysokie stężenie osoczowe związane z zatruciem | |
inne | ||
początkowo 200 mg 3x/d przez 4 tygodnie, następnie do 200 mg 1x/d | Duże ryzyko interakcji i działań niepożądanych (zaburzenia funkcji tarczycy, płuc, wątroby) | |
Uwaga! Wszystkie leki używane do kontroli częstości pracy serca są przeciwwskazane w preekscytacji, np. zespole Wolffa–Parkinsona–White’a.
Z kolei leki stosowane w celu utrzymania rytmu zatokowego zmniejszają częstość napadów migotania przedsionków, poprawiają jakość życia pacjentów oraz spowalniają progresję AF. Należą do nich amiodaron, dronedaron, flekainid, propafenon oraz sotalol.
Przy jednoczesnym występowaniu zaburzeń przewodzenia przed wprowadzeniem leczenia antyarytmicznego należy rozważyć implantację stymulatora.
| Lekdawka | Kryteria włączenia | Uwagi |
|---|---|---|
AF u pacjentów z niewydolnością serca z obniżoną frakcją wyrzutową | Monitorowanie działań niepożądanych | |
AF u pacjentów z niewydolnością serca z zachowaną lub łagodnie obniżoną frakcją, chorobą niedokrwienną serca oraz chorobami zastawkowymi | ||
AF u pacjentów z niewydolnością serca, przerostem lewej komory, chorobą niedokrwienną serca i | Przy jednoczesnym występowaniu epizodów trzepotania przedsionków rozważyć włączenie β-blokera, diltiazemu lub werapamilu | |
AF u pacjentów bez niewydolności serca lub z chorobą niedokrwienną serca | Monitorowanie odstępu QT, funkcji nerek, stężenia potasu w surowicy |
Kardiowersja farmakologiczna i elektryczna. Ablacja i leczenie resynchronizujące
Przeprowadzane są najczęściej w warunkach szpitalnych i mogą przywrócić rytm zatokowy. Najczęściej zaleca się, aby u chorych z migotaniem przedsionków podjąć przynajmniej jedną próbę taką próbę.
W przypadku pacjentów stabilnych hemodynamicznie, u których AF trwa <24 godzin, kardiowersję można przeprowadzić bez wcześniejszego leczenia przeciwkrzepliwego, z wyjątkiem chorych obciążonych wysokim ryzykiem zakrzepowo-zatorowym. U pozostałych pacjentów zaleca się profilaktykę przeciwzakrzepową (NOAC lub VKA) przez co najmniej 3 tygodnie przed kardiowersją i 4 tygodnie po niej, natomiast warto pamiętać, że część chorych będzie wymagać przedłużonego leczenia przeciwkrzepliwego, nawet w przypadku umiarowienia (część nawrotów AF przebiega bezobjawowo).
Jeśli napad migotania przedsionków jest bezobjawowy, celowe jest także zastosowanie postawy wyczekującej – napad AF może ustąpić samoistnie do 48 godzin.
Ablacja ogniska arytmii jest rozważana po ocenie kardiologicznej u pacjentów symptomatycznych, wymagających hospitalizacji z powodu AF, z bradykardią związaną z AF oraz z pauzami.
Ocena skutków leczenia i monitorowanie stanu pacjentaOstatni element kompleksowego leczenia AF zakłada monitorowanie stanu pacjentów, optymalizację leczenia chorób współistniejących i promowanie zdrowego stylu życia. Chory z migotaniem przedsionków powinien pozostawać pod opieką kardiologiczną. W razie wielochorobowości leczenie powinno być multidyscyplinarne. Ważnym elementem jest także edukacja pacjenta dotycząca leczenia przeciwkrzepliwego oraz możliwych powikłań nieleczonego migotania przedsionków. Należy zwrócić uwagę na konieczność informowania lekarza o przyjmowaniu leków wpływających na krzepnięcie podczas kwalifikacji do inwazyjnych zabiegów.
Screening i prewencja AF
Prewencyjne badanie rytmu serca powinno być wykonywane na każdej wizycie lekarskiej u pacjentów powyżej 65. r.ż. W zależności od historii medycznej pacjenta oraz ryzyka zakrzepowo-zatorowego, screening AF może przyjąć formę palpacji tętna lub zastosowania EKG albo Holtera EKG.
Zapobieganie AF bazuje na interwencjach terapeutycznych, takich jak optymalna kontrola innych schorzeń pacjenta oraz edukacja dotycząca stylu życia. Do tych interwencji należą:
- optymalizacja leczenia NT (za pomocą leczenia pierwszego rzutu – ACEI/ARB),
- optymalizacja leczenia niewydolności serca,
- utrzymywanie prawidłowej masy ciała – BMI 20-25 kg/m2,
- utrzymywanie aktywnego stylu życia – 150-300 minut tygodniowo aerobowego wysiłku o umiarkowanej aktywności lub 75-150 minut tygodniowo intensywnego wysiłku aerobowego,
- zminimalizowanie ilości spożywanego alkoholu,
- metformina lub inhibitory SGLT2 u pacjentów wymagających farmakologicznego leczenia cukrzycy.
Przykładowa wizyta
Wywiad
Pacjentka 76-letnia zgłosiła się na wizytę z powodu osłabienia, zawrotów głowy i uczucia kołatania serca. Objawy pojawiły się 4 dni temu i ustąpiły po kilkunastu minutach. Podobne epizody występowały około 4 razy w ostatnim miesiącu. Innym dolegliwościom pacjentka przeczy. Choruje przewlekle na otyłość oraz nadciśnienie tętnicze, leczone walsartanem 80 mg + hydrochlorotiazydem 12,5 mg 1xd, lek przyjmuje nieregularnie. Uczuleń na leki nie podaje, wywiad rodzinny obciążony czynnikami ryzyka sercowo-naczyniowego. Operacje neguje, pali papierosy (ok. 20 paczkolat), alkoholu nie spożywa.
Badanie fizykalne
Pacjentka w stanie ogólnym dobrym, w kontakcie werbalnym logicznym, zorientowana wszechstronnie. Skóra czysta, bez wykwitów patologicznych. Nadmiernie rozwinięta tkanka podskórna (BMI 34 kg/m2). Śluzówki jamy ustnej różowe, podsychające, migdałki podniebienne niepowiększone. Węzły chłonne podżuchwowe niepowiększone. Nad polami płucnymi szmer pęcherzykowy prawidłowy słyszany symetrycznie. Akcja serca niemiarowa, około 90/min, z ubytkiem tętna na obwodzie, BP 150/95 mmHg. Tony serca czyste. Brzuch miękki, niebolesny, bez objawów otrzewnowych, narządy miąższowe niedostępne w badaniu fizykalnym, perystaltyka prawidłowa. Objawy Goldflamma, Chełmońskiego ujemne. W orientacyjnym badaniu neurologicznym bez odchyleń. Objawy oponowe ujemne.
Zalecenia i leczenie
Wykonano badanie EKG, w którym stwierdzono niemiarowość zupełną oraz falę f – rozpoznano migotanie przedsionków. Z uwagi na stabilność hemodynamiczną pacjentki oraz czas trwania epizodu, zdecydowano o włączeniu leczenia przeciwkrzepliwego rywaroksabanem – np. w postaci preparatu Rixacam – w dawce 20 mg 1x/d (wynik w skali CHA2DS2-VA: 3 pkt) oraz skierowaniu pacjentki do poradni kardiologicznej celem dalszego leczenia i diagnostyki, w tym wykonanie badania ECHO celem potwierdzenia wskazań refundacyjnych. Wystawiono również skierowanie na badania laboratoryjne – zlecono wykonanie morfologii krwi obwodowej, badania ogólnego moczu, oznaczenia stężenia kreatyniny z oceną eGFR, TSH, fT3 i fT4, HbA1C, elektrolitów, lipidogramu.
Pacjentkę poinformowano o konieczności regularnego przyjmowania leku przeciwkrzepliwego, jak i leków na nadciśnienie tętnicze, przeprowadzono edukację w zakresie powikłań zakrzepowo-zatorowych. Zaproponowano farmakologiczne leczenie otyłości, zarekomendowano włączenie diety śródziemnomorskiej oraz codziennej, regularnej aktywności fizycznej, np. spaceru. Poinformowano o konieczności ograniczenia palenia papierosów, a najlepiej o zaprzestaniu.
Kody ICD-10
Choroby układu krążenia
Referencje
- Interna Szczeklika 2024. Podręcznik chorób wewnętrznych. Medycyna Praktyczna. Wydanie 15. 2024.
- Wytyczne ESC 2024 dotyczące diagnostyki i leczenia migotania przedsionków opracowane we współpracy z European Association of Cardio‑Thoracic Surgery (EACTS). https://www.escardio.org/Guidelines/Clinical-Practice-Guidelines/Atrial-Fibrillation [ostatni dostęp: 30.11.2024]
- Sałacki, A. J., & Wysokiński, A. (2016). Pacjent z migotaniem przedsionków w praktyce lekarza rodzinnego. Forum Medycyny Rodzinnej, 10(3), 111–118.
- Joglar, J. A., Chung, M. K., Armbruster, A. L., Benjamin, E. J., Chyou, J. Y., Cronin, E. M., Deswal, A., Eckhardt, L. L., Goldberger, Z. D., Gopinathannair, R., Gorenek, B., Hess, P. L., Hlatky, M., Hogan, G., Ibeh, C., Indik, J. H., Kido, K., Kusumoto, F., Link, M. S., Linta, K. T., … Van Wagoner, D. R. (2024). 2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation, 149(1), e1–e156. https://doi.org/10.1161/CIR.0000000000001193
- Steffel, J., Collins, R., Antz, M., Cornu, P., Desteghe, L., Hæusler, K. G., Oldgren, J., Reinecke, H., Roldán, V., Rowell, N., Sinnaeve, P., Vanassche, T., Potpara, T., Camm, A. J., Heidbüchel, H., Reviewers, E., Lip, G. Y., Deneke, T., Dagres, N., . . . Field, M. (2021). 2021 European Heart Rhythm Association Practical Guide on the Use of Non-Vitamin K Antagonist Oral Anticoagulants in Patients with Atrial Fibrillation. Europace, 23(10), 1612–1676. https://doi.org/10.1093/europace/euab065
- Mital, A., Łętowska, M., Chojnowski, K. Polskie zalecenia dotyczące leczenia antagonistami witaminy K. J Transf Med 2013; 6: 41–47.


