Wyszukaj w publikacjach
Przewlekła obturacyjna choroba płuc (POChP) to postępująca choroba układu oddechowego, która stanowi czwartą najczęstszą przyczynę zgonów na świecie [1]. Każdy epizod zaostrzenia pociąga za sobą spadek czynności wentylacyjnej płuc, a brak powrotu funkcji płuc do stanu sprzed incydentu wiąże się ze wzrostem śmiertelności w ciągu roku od hospitalizacji [1,2].
Wywiad
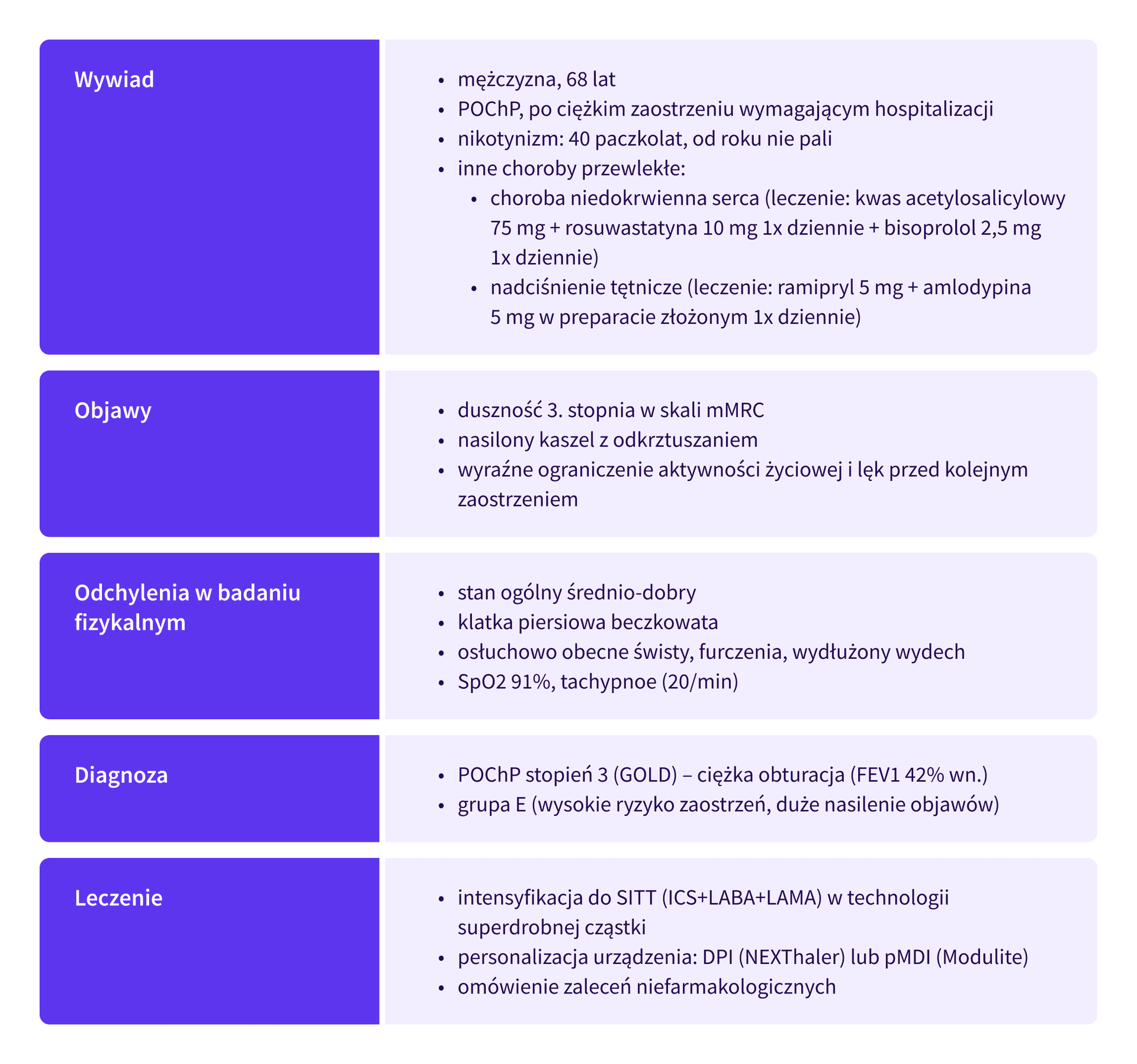
68-letni pacjent zgłosił się na wizytę kontrolną 14 dni po wypisie ze szpitala, gdzie był leczony z powodu ciężkiego zaostrzenia POChP. Chory od lat stosuje terapię dwuskładnikową opartą o glikopironium z formoterolem (LAMA+LABA), jednak w ostatnim roku dwukrotnie wymagał antybiotykoterapii ambulatoryjnie, a ostatni incydent zakończył się hospitalizacją. Pacjent zgłasza, że brakuje mu tchu nawet przy prostych czynnościach, jak ubieranie się, co wskazuje na stopień 3 w skali mMRC [3].
Pacjent jest byłym palaczem (wywiad 40 paczkolat), zaprzestał palenia rok temu.
Chory przyjmuje na stałe:
- kwas acetylosalicylowy w dawce 75 mg 1x dziennie, rosuwastatynę w dawce 10 mg dziennie i bisoprolol w dawce 2,5 mg 1x dziennie z powodu choroby niedokrwiennej serca,
- ramipryl 5 mg + amlodypina 5 mg w preparacie złożonym 1x dziennie z powodu nadciśnienia tętniczego.
Skarży się na trudności w obsłudze dotychczasowego inhalatora, ponieważ często ma wrażenie, że lek „zostaje w gardle", co może sugerować nieprawidłową technikę inhalacji lub zbyt słaby przepływ wdechowy dla stosowanego urządzenia.
Badanie fizykalne
W badaniu fizykalnym pacjent w stanie ogólnym średnio-dobrym, wydolny krążeniowo, oddechowo wydolny w spoczynku, ale z widoczną pracą dodatkowych mięśni oddechowych, nawet w trakcie prowadzenia spokojnej rozmowy.
Stwierdzono następujące wartości parametrów życiowych:
- BP: 138/84 mmHg,
- HR: 88/min,
- SpO2: 91%,
- T: 36,7 °C.
Klatka piersiowa beczkowata, a jej ruchomość, choć symetryczna, jest znacząco ograniczona. W trakcie osłuchiwania pól płucnych dominuje osłabienie szmeru pęcherzykowego z towarzyszącymi świstami i furczeniami, które stają się szczególnie słyszalne w trakcie wyraźnie wydłużonej fazy wydechowej. Nawrót kapilarny wynosi poniżej 2 sekund, a w obrębie kończyn dolnych nie stwierdza się obrzęków.
Diagnoza
Na podstawie historii leczenia i ostatniej hospitalizacji, pacjenta zakwalifikowano do grupy E (ang. exacerbations) według klasyfikacji GOLD 2025/2026 – warunek: jedno lub więcej (≥ 1) umiarkowane lub ciężkie zaostrzenie w poprzednich 12 miesiącach [4]. Wykonane po hospitalizacji badanie spirometryczne wykazało wskaźnik Tiffeneau (FEV1/FVC) <0,7 oraz FEV1 na poziomie 42% wartości należnej, co potwierdza ciężkie zaburzenie obturacyjne i odpowiada stopniu 3 wg GOLD [3,4].
Zastosowane leczenie
W ramach intensyfikacji leczenia wdrożono terapię potrójną (SITT) w jednym inhalatorze, łączącą substancje z grup ICS (beklometazon), LABA (formoterol) oraz LAMA (glikopironium). Zastosowanie jednego inhalatora zamiast kilku znacząco poprawia przestrzeganie zaleceń terapeutycznych oraz współpracę z pacjentem (ang. compliance, adherence) [4], co przekłada się na poprawę kontroli objawów oraz zapobieganie kolejnym zaostrzeniom.
Zdecydowano o wdrożeniu SITT (np. Trimbow) opartej na trzech synergistycznie działających substancjach czynnych:
- beklometazon (ICS) – silny glikokortykosteroid, który wykazuje miejscowe działanie przeciwzapalne w obrębie płuc, redukując obrzęk i podrażnienie dróg oddechowych;
- formoterol (LABA) – selektywny, długo działający agonista receptorów β2-adrenergicznych, który powoduje szybki i trwały rozkurcz mięśni gładkich oskrzeli, ułatwiając przepływ powietrza;
- glikopironium (LAMA) – długo działający antagonista receptorów muskarynowych (cholinolityk), który blokuje działanie acetylocholiny na mięśnie gładkie dróg oddechowych, prowadząc do ich rozszerzenia [5].
W POChP proces zapalny i przebudowa toczą się głównie w drobnych drogach oddechowych (<2 mm średnicy). Standardowe cząstki leków często tam nie docierają, zamiast tego osadzając się w górnych drogach oddechowych. Superdrobna cząstka (np. Trimbow) zapewnia wysoką depozycję płucną i penetrację do dystalnych odcinków drzewa oskrzelowego, co przekłada się na skuteczniejszą kontrolę choroby i komfort pacjenta.
Rola szczytowego przepływu wdechowego (PIF) w doborze inhalatora
Kluczem do skutecznej depozycji leku w drogach oddechowych jest dostosowanie urządzenia do wydolności mechanicznej płuc pacjenta na podstawie szczytowego przepływu wdechowego (ang. peak inspiratory flow, PIF), parametru, który informuje o tym, czy chory jest w stanie wygenerować siłę wdechu niezbędną do pokonania oporu wewnętrznego inhalatora. Większość dostępnych inhalatorów proszkowych (DPI) jest pasywna – to pacjent swoją energią wdechu musi przeprowadzić proces dezagregacji proszku (rozbicia go na drobne, terapeutyczne cząstki). Jeśli PIF jest zbyt niski, proces ten jest nieefektywny, a lek osadza się głównie w jamie ustnej i gardle, zamiast dotrzeć do oskrzeli [6].
Sprawdzenie PIF pozwala uniknąć błędu terapeutycznego, polegającego na wyborze urządzenia, którego pacjent fizycznie nie jest w stanie obsłużyć.
Zaawansowana mechanika NEXThaler (DPI)
NEXThaler to inhalator proszkowy typu DPI, którego konstrukcja ma na celu wyeliminowanie najczęstszych błędów popełnianych przez pacjentów.
- Mechanizm BAM (ang. breath actuated mechanism) – system aktywowany wdechem. W przeciwieństwie do innych DPI, NEXThaler uwalnia dawkę leku dopiero w momencie, gdy pacjent osiągnie odpowiedni PIF. Zapobiega to traceniu leku w przypadku zbyt słabego lub płytkiego wdechu.
- Potrójny system informacji zwrotnej – adherencja w POChP jest często niesatysfakcjonująca z powodu braku pewności pacjenta, czy przyjął lek. NEXThaler rozwiązuje to w trzech wymiarach:
- słuchowym – charakterystyczne „kliknięcie” potwierdzające aktywację dawki do inhalacji przez pacjenta,
- smakowym – obecność laktozy jako nośnika pozwala pacjentowi poczuć słodki smak leku,
- wzrokowym – licznik dawek, który zmienia się wyłącznie po wykonaniu pełnej i efektywnej inhalacji, a nie po samym otwarciu wieczka [7].
Dzięki maksymalnie uproszczonej, trzyetapowej procedurze obsługi, NEXThaler jest optymalnym wyborem dla pacjentów z deficytami poznawczymi oraz ograniczoną sprawnością manualną w przebiegu schorzeń układu ruchu. Intuicyjność urządzenia minimalizuje ryzyko błędów technicznych, zapewniając skuteczną realizację schematu leczenia u chorych wymagających szczególnego wsparcia w procesie terapeutycznym.
Technologia Modulite w inhalatorach ciśnieniowych (pMDI)
W grupie chorych o niskim przepływie wdechowym (PIF), technologia ciśnieniowa Modulite staje się podstawą terapii dzięki mechanizmom ułatwiającym poprawną inhalację mimo ewentualnych deficytów koordynacyjnych, pozwala na:
- minimalizowanie błędów technicznych – tradycyjne inhalatory pMDI wymagają idealnego zgrania momentu uwolnienia dawki z początkiem wdechu; technologia Modulite (np. Trimbow) optymalizuje aerozol, tak aby chmura leku poruszała się wolniej i była bardziej stabilna, co daje to pacjentowi większy margines błędu czasowego;
- wytwarzanie aerozolu superdrobnocząstkowego – Modulite (np. Trimbow) pozwala na uzyskanie roztworu, z którego generowane są cząstki o bardzo małej średnicy; dzięki temu, nawet przy słabym wysiłku wdechowym, cząstki te zachowują zdolność do głębokiej penetracji płuc, omijając przeszkody anatomiczne górnych dróg oddechowych [8].
| Cecha / Profil pacjenta | NEXThaler (DPI) | pMDI (technologia Modulite) |
|---|---|---|
Koordynacja ręka–oddech | Idealny: System BAM (breath actuated mechanism) automatycznie uwalnia dawkę podczas wdechu, eliminując potrzebę synchronizacji | Wysoka tolerancja: Technologia Modulite kompensuje błędy synchronizacji dzięki wolniejszej chmurze aerozolu |
Siła wdechu (PIF) | Zalecany: Skuteczny nawet przy niższym PIF; preferowany u pacjentów z nasiloną hiperinflacją, którzy mają trudność z innymi DPI | Standard: Najlepszy wybór dla pacjentów o bardzo niskiej sile wdechowej, niezdolnych do uruchomienia inhalatora proszkowego |
Sprawność manualna i motoryczna | Rekomendowany: Prosty w obsłudze dla osób starszych i pacjentów z ograniczeniami ruchowymi (np. choroby układu ruchu) | Wymaga oceny: Naciśnięcie pojemnika może być trudne przy dużych deformacjach stawów dłoni, choć Modulite zwiększa margines błędu |
Funkcje poznawcze | Optymalny: Wyjątkowo prosty (tylko 3 kroki obsługi); odpowiedni przy łagodnych zaburzeniach funkcji poznawczych | Standardowy: Wymaga zapamiętania sekwencji (wydech, naciśnięcie–wdech) |
Pewność przyjęcia dawki | Potrójny feedback: Pacjent słyszy (kliknięcie), czuje (smak laktozy) i widzi (licznik dawek), że inhalacja była skuteczna | Weryfikacja subiektywna: Pacjent czuje chłodną chmurę aerozolu, co potwierdza uwolnienie dawki |
Profil choroby | Umiarkowana do ciężkiej postać POChP: Brak kontroli na terapii 2-składnikowej lub pacjenci stosujący 2–3 osobne inhalatory | Zaawansowana POChP: Pacjenci po ciężkich zaostrzeniach, osłabieni, z niską wydolnością mechaniczną płuc |
Zalecenia niefarmakologiczne i profilaktyka zakażeń
W ramach profilaktyki i postępowania niefarmakologicznego kluczowe znaczenie ma edukacja pacjenta dotycząca higieny jamy ustnej. Ze względu na włączenie glikokortykosteroidu wziewnego (beklometazonu) i związane z tym ryzyko wystąpienia kandydozy, chory został poinstruowany o bezwzględnej konieczności każdorazowego płukania jamy ustnej po inhalacji leku. Dodatkowo, w celu redukcji ryzyka kolejnych infekcji zaostrzających przebieg choroby, zalecono wykonanie szczepień ochronnych zgodnie z aktualnymi zaleceniami, w tym przeciwko RSV, grypie i pneumokokom. Pacjent otrzymał również skierowanie na oddział rehabilitacji pulmonologicznej, gdzie pod okiem specjalistów przejdzie trening efektywnego kaszlu oraz drenażu wydzieliny oskrzelowej.
Poinformowano pacjenta, że należy pilnie zgłosić się do lekarza w przypadku:
- wystąpienia gorączki i zmiany barwy plwociny na ropną – (ryzyko zapalenia płuc istotne przy stosowaniu ICS),
- nagłego pogorszenie duszności nieustępujące po lekach doraźnych (SABA),
- pojawienia się obrzęków kończyn dolnych lub sinicy warg.
CHIESI/MŁU/TNH/2026/01/11
Źródła
- World Health Organization: WHO & World Health Organization: WHO. (2024, November 6). Chronic obstructive pulmonary disease (COPD). https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd) [ostatni dostęp: 17.01.2026 r.]
- GBD Chronic Respiratory Disease Collaborators (2020). Prevalence and attributable health burden of chronic respiratory diseases, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. The Lancet. Respiratory medicine, 8(6), 585–596. https://doi.org/10.1016/S2213-2600(20)30105-3
- Gajewski, P. (2025). Interna Szczeklika 2025/2026 – mały podręcznik. Medycyna Praktyczna.
- Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of COPD 2026 report. https://goldcopd.org/2026-gold-report [ostatni dostęp: 17.01.2026 r.]
- Charakterystyka Produktu Leczniczego. Trimbow.
- Chen, S. Y., Huang, C. K., Peng, H. C., Yu, C. J., & Chien, J. Y. (2020). Inappropriate Peak Inspiratory Flow Rate with Dry Powder Inhaler in Chronic Obstructive Pulmonary Disease. Scientific reports, 10(1), 7271. https://doi.org/10.1038/s41598-020-64235-6
- Emeryk, A., & Pirożyński, M. (2015). Nowe inhalatory suchego proszku [New dry powder inhalers]. Pneumonologia i alergologia polska, 83(1), 83–87. https://doi.org/10.5603/PiAP.2015.0012
- Acerbi, D., Brambilla, G., & Kottakis, I. (2007). Advances in asthma and COPD management: delivering CFC-free inhaled therapy using Modulite technology. Pulmonary pharmacology & therapeutics, 20(3), 290–303. https://doi.org/10.1016/j.pupt.2006.05.005



