Wyszukaj w publikacjach
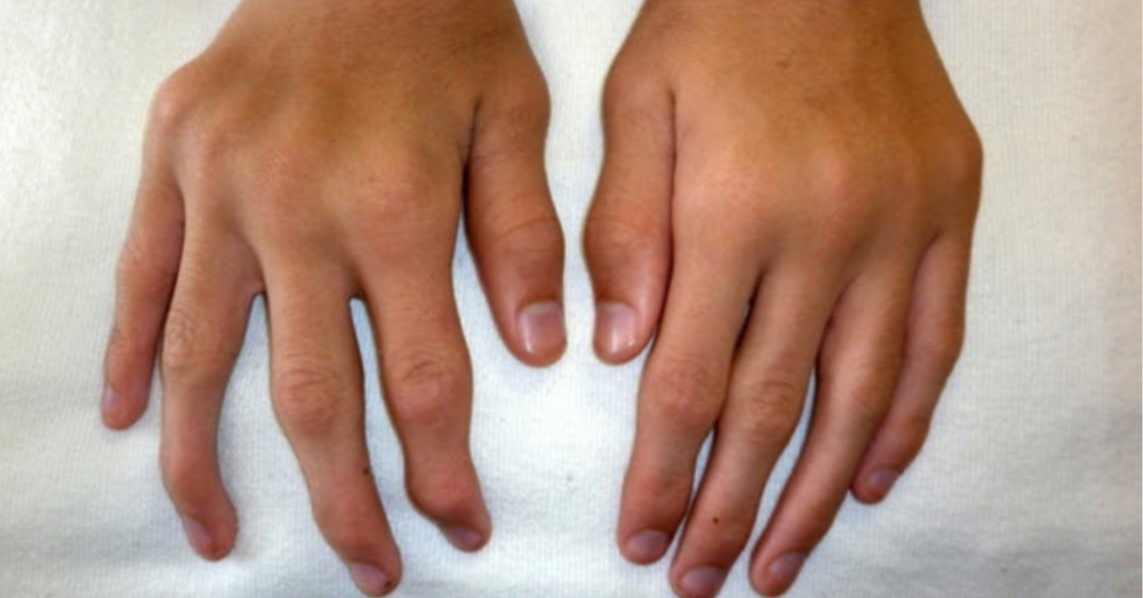
Mukopolisacharydozy (MPS) stanowią grupę rzadkich, dziedzicznych chorób metabolicznych o złożonym i wielonarządowym charakterze. Ich wspólnym mianownikiem jest zaburzenie aktywności enzymów odpowiedzialnych za rozkład glikozaminoglikanów. Choć rzadkie, stanowią istotne wyzwanie diagnostyczne i terapeutyczne. Zmienność objawów, ich powolny rozwój i niespecyficzność na wczesnym etapie często prowadzą do opóźnionej diagnozy.
Patofizjologia i obraz kliniczny MPS
Mukopolisacharydozy (MPS) stanowią heterogenną grupę dziedzicznych chorób metabolicznych, klasyfikowanych według rodzaju defektu enzymatycznego odpowiedzialnego za degradację określonych glikozaminoglikanów. Wyróżnia się obecnie kilka głównych typów MPS, z których każdy charakteryzuje się:
- odmiennym niedoborem enzymu,
- profilem gromadzonych mukopolisacharydów,
- specyficznym obrazem klinicznym.
Do najczęstszych należą:
- MPS typu I (zespół Hurler, Hurler–Scheie i Scheie),
- MPS typu II (zespół Huntera),
- MPS typu III (zespół Sanfilippo) obejmująca cztery podtypy (A, B, C i D),
- MPS typu IV (zespół Morquio, odmiany A i B),
- MPS typu VI (zespół Maroteaux–Lamy),
- MPS typu VII (zespół Sly’a),
- MPS typu IX (zespół Natowicza).
Wszystkie typy MPS dziedziczone są autosomalnie recesywnie, z wyjątkiem MPS II, której dziedziczenie jest recesywne sprzężone z chromosomem X. Mimo wspólnego mechanizmu biochemicznego, poszczególne typy różnią się:
- ciężkością przebiegu,
- dynamiką progresji,
- zakresem zajęcia narządów.
Stanowi to podstawę ich klasyfikacji klinicznej i diagnostycznej.
| Typ MPS | Nazwa zespołu / podtypy | Deficyt enzymatyczny | Gen | Gromadzone glikozaminoglikany (GAG) | Sposób dziedziczenia | Charakterystyka kliniczna |
|---|---|---|---|---|---|---|
MPS I | zespół Hurler, Hurler–Scheie, Scheie | α-L-iduronidaza | IDUA | siarczan dermatanu, siarczan heparanu | autosomalne recesywne | ciężka, klasyczna postać z deformacjami kostnymi, hepatosplenomegalią, kardiomiopatią i często niepełnosprawnością intelektualną; łagodniejsze formy z wolniejszym przebiegiem i zachowanym rozwojem intelektualnym |
MPS II | zespół Huntera | iduronian-2-sulfataza | IDS | siarczan dermatanu, siarczan heparanu | recesywne sprzężone z chromosomem X | choroba występująca prawie wyłącznie u chłopców; objawy podobne do MPS I, często z postępującymi zmianami kostnymi, oddechowymi i kardiologicznymi; w cięższych postaciach obecne zaburzenia neurologiczne |
MPS III | zespół Sanfilippo (A, B, C, D) | N-sulfoglukozamina-sulfhydrolaza (A), α-N-acetyloglukozaminidaza (B), heparan-N-acetylotransferaza (C), N-acetyloglukozamina-6-sulfataza (D) | SGSH (A), NAGLU (B), HGSNAT, ©, GNS (D) | siarczan heparanu | autosomalne recesywne | dominują objawy neurologiczne: postępująca utrata funkcji poznawczych, zaburzenia zachowania, sen, ruchu; zmiany somatyczne mniej nasilone |
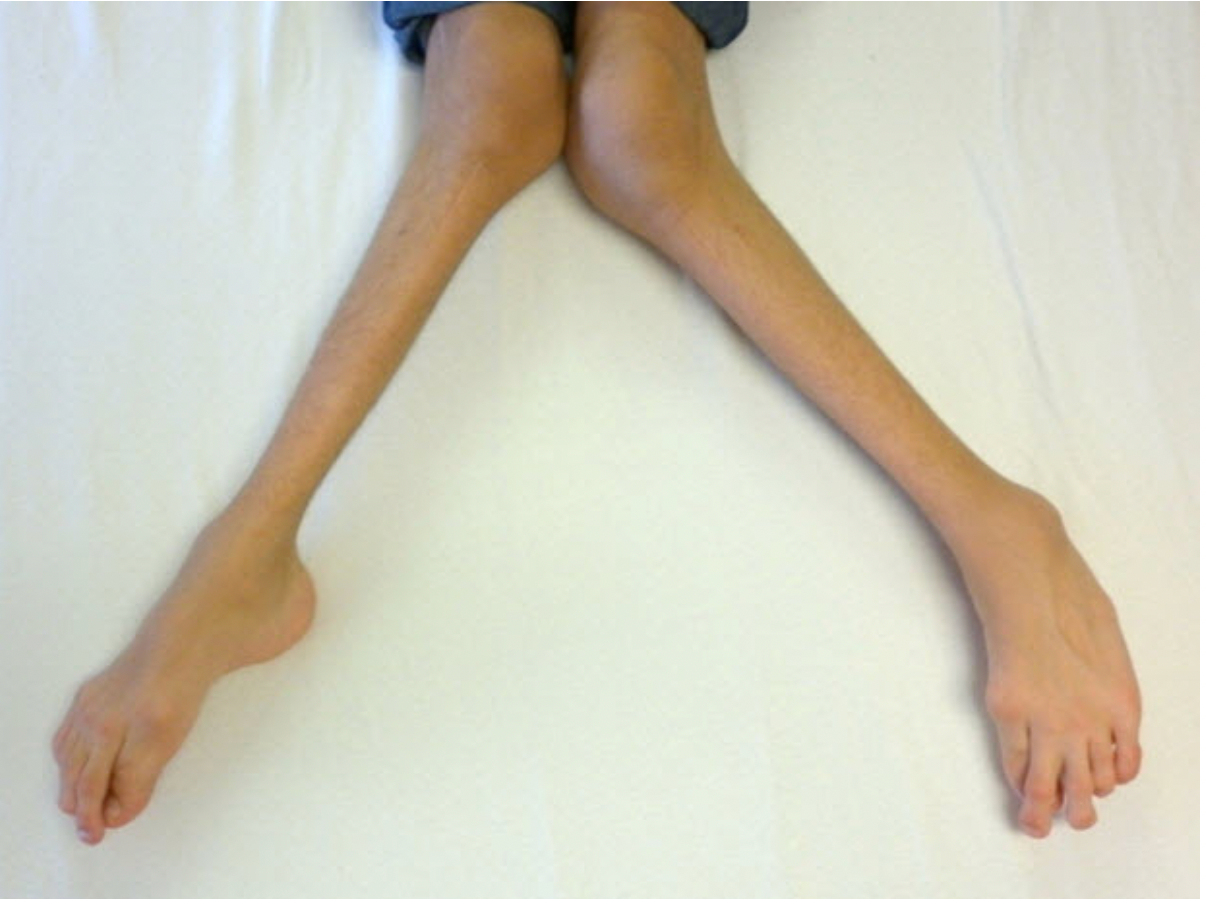
MPS IV | zespół Morquio (A, B) | N-acetylogalaktozamina-6-sulfataza (A) lub β-galaktozydaza (B) | GALNS, (A), GLB1 (B) | siarczan keratanu | autosomalne recesywne | zmiany głównie w układzie kostno-stawowym: niskorosłość, koślawość kolan, zniekształcenia kręgosłupa, bez upośledzenia umysłowego |
MPS VI | zespół Maroteaux–Lamy | N-acetylogalaktozamina-4-sulfataza (arylosulfataza B) | ARSB | siarczan dermatanu | autosomalne recesywne | objawy somatyczne podobne do MPS I, lecz bez zaburzeń neurologicznych; częste zmętnienie rogówki, wady serca, przykurcze stawów |
MPS VII | zespół Sly’a | β-glukuronidaza | GUSB | siarczan dermatanu, siarczan chondroityny | autosomalne recesywne | zmienny przebieg: od ciężkich postaci z obrzękiem płodu po łagodniejsze formy z niskorosłością, deformacjami kostnymi, wadami serca i hepatosplenomegalią |
MPS IX | zespół Natowicza | hialuronidaza 1 | HYAL1 | kwas hialuronowy | autosomalne recesywne | najrzadsza postać; łagodny przebieg z torbielami w tkankach miękkich, bez ciężkich zmian narządowych |
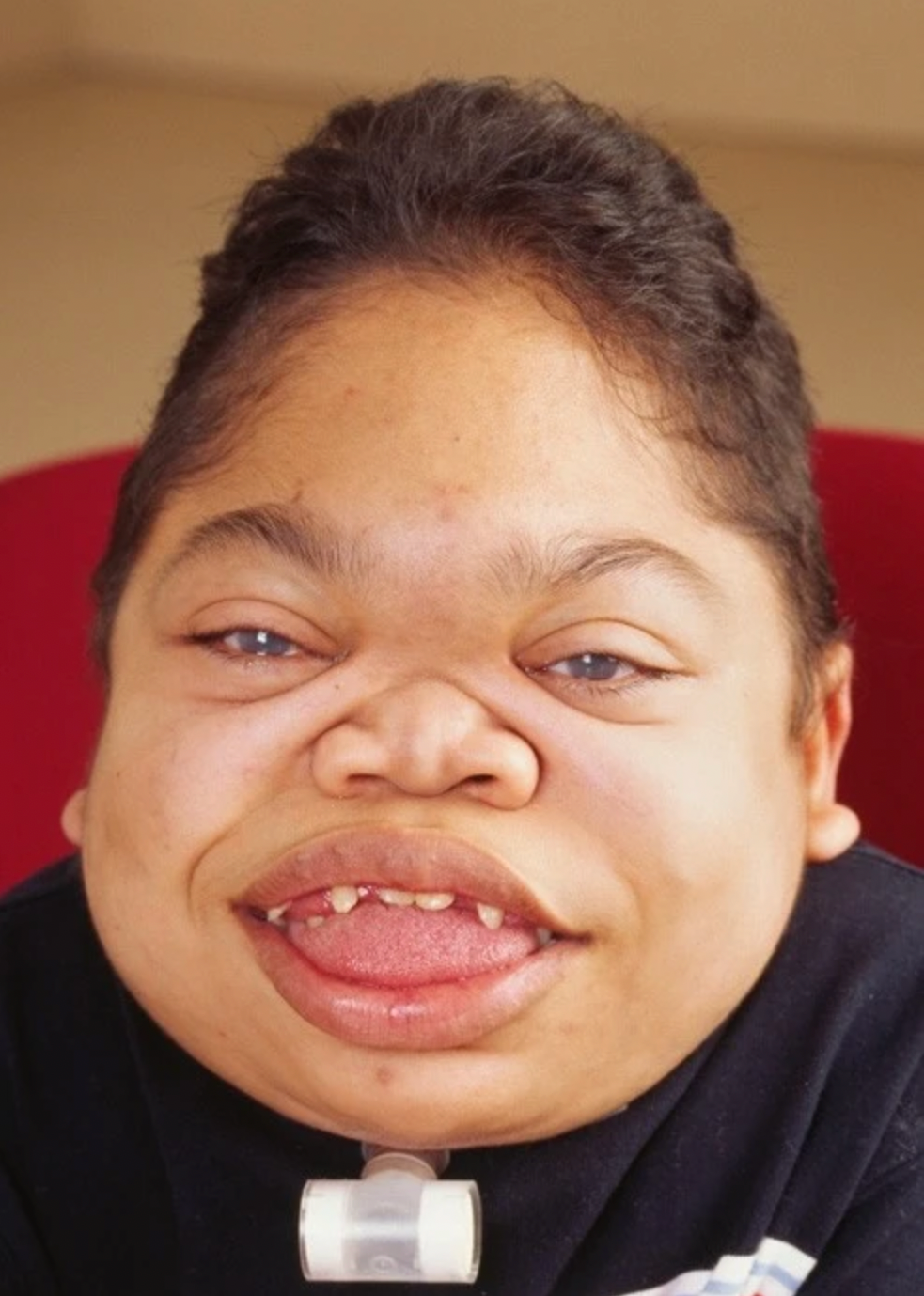
Zniekształcenie obu nadgarstków i powiększenie stawów u 15-letniego pacjenta z MPS IVA.

Diagnostyka zaburzeń rozkładu glikozaminoglikanów
Rozpoznanie mukopolisacharydozy opiera się na połączeniu:
- charakterystycznego obrazu klinicznego,
- wyników badań biochemicznych, enzymatycznych i genetycznych.
W pierwszym etapie diagnostyki wykonuje się analizę wydalania glikozaminoglikanów (GAG) w moczu, która pozwala określić ich ilość i rodzaj. U osób zdrowych wykrywa się głównie siarczan chondroityny, natomiast obecność dodatkowych frakcji sugeruje poszczególne typy MPS.
Badanie to ma jednak charakter przesiewowy i w przypadku wyników niejednoznacznych wymaga powtórzenia lub pogłębienia diagnostyki. Kluczowe znaczenie ma oznaczenie aktywności enzymatycznej w:
- leukocytach,
- surowicy,
- fibroblastach skóry.
Umożliwia to identyfikację konkretnego enzymu o obniżonej lub zniesionej aktywności, a tym samym określenie typu choroby.
W wybranych przypadkach, zwłaszcza w diagnostyce nosicielstwa lub potwierdzaniu wątpliwych wyników biochemicznych, wykonuje się analizę genetyczną w celu identyfikacji mutacji w odpowiednich genach. Diagnostyka prenatalna jest możliwa poprzez ocenę aktywności enzymatycznej w komórkach płynu owodniowego lub trofoblastu. Właściwe rozpoznanie typu mukopolisacharydozy ma znaczenie nie tylko dla potwierdzenia choroby, ale także dla planowania terapii, oceny rokowania i poradnictwa genetycznego w rodzinie.
Leczenie – jak postępować po rozpoznaniu MPS?
Postępowanie terapeutyczne po rozpoznaniu mukopolisacharydozy wymaga indywidualnego podejścia, ukierunkowanego zarówno na leczenie przyczynowe, jak i objawowe, z uwzględnieniem specyfiki danego typu choroby oraz stopnia jej zaawansowania. Podstawą terapii przyczynowej jest enzymatyczna terapia zastępcza (ERT), polegająca na podawaniu rekombinowanego enzymu brakującego w organizmie chorego. Leczenie to umożliwia:
- redukcję poziomu glikozaminoglikanów w tkankach,
- poprawę wydolności oddechowej,
- poprawę funkcji serca,
- poprawę ruchomości stawów,
- poprawę ogólnej kondycji pacjenta.
Skuteczność terapii w zakresie objawów neurologicznych jest jednak ograniczona, ze względu na brak przenikania enzymu przez barierę krew–mózg. U wybranych pacjentów z ciężkimi postaciami MPS typu I zastosowanie znajduje przeszczepienie komórek macierzystych szpiku kostnego lub krwi pępowinowej, które może spowolnić postęp choroby i częściowo zapobiec jej powikłaniom.
Leczenie objawowe obejmuje kompleksową opiekę wielospecjalistyczną – pulmonologiczną, kardiologiczną, ortopedyczną, okulistyczną, laryngologiczną i neurologiczną – ukierunkowaną na łagodzenie dolegliwości, korekcję wad anatomicznych oraz zapobieganie powikłaniom. Ważną rolę odgrywa rehabilitacja, fizjoterapia oraz wsparcie psychologiczne i edukacyjne. Współczesne kierunki badań koncentrują się na doskonaleniu terapii enzymatycznej, terapii genowej oraz metod zmniejszających gromadzenie glikozaminoglikanów, co daje nadzieję na dalszą poprawę rokowania i jakości życia chorych na MPS.
Rokowanie w mukopolisacharydozach
Rokowanie w mukopolisacharydozach jest zróżnicowane i zależy od:
- typu choroby,
- aktywności resztkowej enzymu,
- wieku wystąpienia objawów,
- tempa progresji objawów.
W najcięższych postaciach, ujawniających się we wczesnym dzieciństwie, przebieg jest gwałtowny i prowadzi do przedwczesnego zgonu w pierwszej lub drugiej dekadzie życia, najczęściej w wyniku powikłań ze strony układu oddechowego lub krążenia. W lżejszych odmianach choroby, w których aktywność enzymatyczna jest częściowo zachowana, tempo postępu schorzenia jest wolniejsze, a chorzy mogą dożywać wieku dorosłego. U pacjentów z zajęciem ośrodkowego układu nerwowego rokowanie jest niekorzystne, gdyż mimo postępów terapeutycznych nie istnieją skuteczne metody zatrzymujące neurodegenerację. Z kolei u chorych, u których dominują objawy somatyczne bez zaburzeń neurologicznych, właściwie prowadzone leczenie enzymatyczne i rehabilitacja mogą znacząco poprawić jakość i długość życia. Wczesne rozpoznanie oraz wdrożenie terapii przyczynowej i objawowej mają kluczowe znaczenie dla spowolnienia postępu choroby i ograniczenia jej skutków, a długofalowa opieka wielospecjalistyczna pozwala na lepsze funkcjonowanie pacjentów w życiu codziennym.
Źródła
- Mucopolysaccharidoses. National Institute of Neurological Disorders and Stroke. https://www.ninds.nih.gov/health-information/disorders/mucopolysaccharidoses
- Clarke, L. A. (2024). Mucopolysaccharidosis type I. GeneReviews® - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK1162/
- Scarpa, M., & Lampe, C. (2025). Mucopolysaccharidosis type II. GeneReviews® - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK1274/
- Wagner, V. F., & Northrup, H. (2019). Mucopolysaccharidosis type III. GeneReviews® - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK546574/
- Regier, D. S., Oetgen, M., & Tanpaiboon, P. (2021). Mucopolysaccharidosis type IVA. GeneReviews® - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK148668/
- D'Avanzo, F., Zanetti, A., De Filippis, C., & Tomanin, R. (2021). Mucopolysaccharidosis Type VI, an Updated Overview of the Disease. International journal of molecular sciences, 22(24), 13456. https://doi.org/10.3390/ijms222413456
- Sun, A., & Wang, R. (2024). Mucopolysaccharidosis type VII. GeneReviews® - NCBI Bookshelf. https://www.ncbi.nlm.nih.gov/books/NBK598990/
- Zhou, J., Lin, J., Leung, W. T., & Wang, L. (2020). A basic understanding of mucopolysaccharidosis: Incidence, clinical features, diagnosis, and management. Intractable & rare diseases research, 9(1), 1–9. https://doi.org/10.5582/irdr.2020.01011



